Электроліз: Розніца паміж версіямі
| [дагледжаная версія] | [дагледжаная версія] |
JerzyKundrat (размовы | уклад) дрНяма тлумачэння праўкі |
др added Category:Электрычны ток using HotCat |
||
| Радок 17: | Радок 17: | ||
[[Катэгорыя:Электрахімія]] |
[[Катэгорыя:Электрахімія]] |
||
[[Катэгорыя:Акісляльна-аднаўленчыя рэакцыі]] |
[[Катэгорыя:Акісляльна-аднаўленчыя рэакцыі]] |
||
[[Катэгорыя:Электрычны ток]] |
|||
Версія ад 23:49, 5 снежня 2017
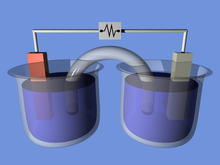
Электро́ліз («электра» + гр. λύσις «люзіс» — вызваленне, паслабленне) — хімічныя рэакцыі, якія працякаюць пад дзеяннем электрычнага току на электродах, утопленых у раствор, расплаў або цвёрды электраліт.
Працэс выдзялення складючых часткак (іонаў) растворанага рэчыва (электраліту) пад дзеяннем знешняга электрычнага поля. Электроліз з'яўляецца адным з тыпаў электрычнага току. У адрозненне ад току ў металах, электроліз абумоўлены пераносам рэчыва.
У электрычным полі дадатна зараджаныя іоны (катыёны) рухаюцца да катода, адмоўна зараджаныя (аніёны) — да анода. На катодзе адбываецца аднаўленне, на анодзе — акісленне іонаў або мапекул, якія ўваходзяць у састаў электраліту. Колькасць рэчываў, што ўтвараюцца на электродах, і электрычны зарад, які праходзіць праз электраліт, звязаны законамі Фарадэя.
Звычайна электроліз ажыццяўляюць у электралізёрах. 3 дапамогай электролізу ажыццяўляюць рэакцыі акіслення і аднаўлення з вялікім выхадам і высокай селектыўнасцю, якія ў звычайных хімічных працэсах цяжка дасягальныя. Гэта дазваляе выкарыстоўваць лектроліз для прамысловага атрымання і ачысткі многіх рэчываў. Напрыклад, электролізам водных раствораў атрымліваюць і ачышчаюць медзь, цынк, кадмій, нікель і іншыя металы. Электролізам расплаваў — атрымліваюць алюміній, натрый, літый, кальцый і інш. Электроліз выкарыстоўваюць таксама ў гальванатэхніцы, электрасінтэзе і інш.
Літаратура
- Электроліз // БЭ ў 18 т. Т. 18. Кн. 1. Мн., 2004.
