Планетарная мадэль атама
Артыкул вымагае праверкі арфаграфіі Удзельнік, які паставіў шаблон, не пакінуў тлумачэнняў. |
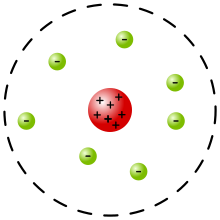
Планетарная мадэль атама, або мадэль атама Рэзерфо́рда — гістарычна важная мадэль будовы атама, прапанаваная Эрнэстам Рэзерфордам у класічным артыкуле[1], апублікаваным у 1911 г., на аснове аналізу і статыстычнай апрацоўкі вынікаў эксперыментаў па рассейванню альфа-часціц у тонкай залатой фользе, выкананых Гейгерам і Марсдэнам у 1909 г.[1]
У гэтай мадэлі Рэзерфорд апісвае атам як сістэму з маленечкага станоўча зараджанага ядра, у якім засяроджана амаль уся маса атама, і электронаў, якія круцяцца вакол яго, — падобна таму, як планеты рухаюцца вакол Сонца.
Планетарная мадэль атама адпавядае сучасным прадстаўленням аб будове атама з удакладненнямі, што рух электронаў не можа быць апісаны законамі класічнай механікі і мае квантавамеханічны характар
Гістарычна планетарная мадэль Рэзерфорда прыйшла на змену «мадэлі слівавага пудынгу» Джозэфа Джона Томсана, згодна з якой адмоўна зараджаныя электроны змешчаны ўнутры атама з размеркаваным па ўсяму аб’ёму станоўчым зарадам, як разыначкі ў пудынгу.
Перадгісторыя[правіць | правіць зыходнік]

Да 1904 года японскі фізік Нагаока распрацаваў раннюю, як аказалася пасля, памылковую «планетарную мадэль» атама («атам тыпа Сатурна»)[2]. Мадэль была пабудавана на аналогіі з разлікамі ўстойлівасці кольцаў Сатурна (кольцы ўраўнаважаны з-за вельмі вялікай масы планеты). Мадэль Нагаокі была няправільная, але два следствы з яе аказаліся прароцкімі:
- ядро атама сапраўды вельмі масіўнае;
- электроны ўтрымліваюцца на арбіце дзякуючы электрастатычным сілам (падобна таму, як кольцы Сатурна ўтрымліваюцца гравітацыйнымі сіламі).
Новую мадэль будовы атама Рэзерфорд прапанаваў у 1911 годзе на аснове аналізу эксперыментаў па рассейванню альфа-часціц у залатой фользе, праведзеных у 1909 г. пад яго кіраўніцтвам.
Пры гэтым рассеянні вялікая, нечакана статыстычна невытлумачальная, колькасць альфа-часціц рассейвалася на большыя вуглы, што сведчыла аб тым, што цэнтр рассеяння мае невялікія памеры, але ў ім значны электрычны зарад і маса атама.
Разлікі Рэзерфорда паказалі, што цэнтр рассейвання, зараджаны станоўча ці адмоўна, павінен быць па меншай меры ў 3000 разоў меншы за памеры атама, які ў той час ужо быў вядомы і ацэньваўся як прыкладна 10−10 м. Паколькі ў той час электроны ўжо былі вядомыя, а іх маса і зарад вызначаны, то цэнтр рассейвання, які пазней назвалі ядром, павінен быў мець процілеглы электронам зарад. Рэзерфорд не звязаў велічыню зараду з атамным нумарам. Гэтая выснова была зроблена пазней. А сам Рэзерфорд выказаў здагадку, што зарад ядра прапарцыянальны атамнай масе. Сувязь электрычнага зараду ядра з атамным нумарам хімічнага элемента ўстанавіў Генры Мозлі ў эксперыментах, выкананых у 1913 г.
Недахопам планетарнай мадэлі была немагчымасць тлумачэння ёю ўстойлівасцi атамаў. З класічнай электрадынамікі вынікае, што паколькі электроны рухаюцца вакол ядра, адчуваючы цэнтраімклівае паскарэнне як планеты вакол Сонца, то яны па законах класічнай электрадынамікі павінны выпраменьваць электрамагнітныя хвалі, губляючы пры гэтым на выпраменьванне кінетычную энергію арбітальнага руху, і ў выніку «ўпасці» на ядро. Разлікі, выкананыя з дапамогай метадаў класічнай электрадынамікі паказваюць, што электроны павінны «ўпасці» на ядро за час парадку 10−11 с.
Гэтая супярэчнасць была знята наступным развіццём планетарнай мадэлі ў мадэлі атама Бора, у якой за аснову былі ўзяты іншыя, адметныя ад класічных законы арбітальнага руху электронаў, як хвалі дэ Бройля. Вынікі эксперыментаў, якія цалкам супярэчылі вывадам класічнай электрадынамікі, былі растлумачаны з развіццём квантавай механікі.
Эксперыментальная аснова для мадэлі[правіць | правіць зыходнік]
Рэзерфорд перавярнуў мадэль Томсана ў 1911 годзе сваім вядомым эксперыментам з залатой фольгай, у якім ён прадэманстраваў, што атам мае вельмі маленькае і цяжкае ядро. Рэзерфорд распрацаваў эксперымент, у якім выкарыстаў альфа-часціцы, выпушчаныя радыеактыўным элементам як зонды для нябачнага свету атамнай структуры. Томсан лічыў, што прамень пройдзе прама праз залатую фольгу. Большасць прамянёў прайшлі праз фольгу, але некаторыя былі адхілены.
Рэзерфорд прадставіў уласную фізічную мадэль субатамнай структуры ў якасці інтэрпрэтацыі нечаканых эксперыментальных вынікаў. У ім атам складаецца з цэнтральнага зараду (гэта сучаснае атамнае ядро, але Рэзерфорд не выкарыстоўваў тэрмін «ядро» ў сваёй працы), акружанага воблакам (меркавана) электронаў, якія круцяцца вакол яго. У гэтым травеньскім артыкуле 1911 года Рэзерфорд надаў увагу вузкай вобласці высокага станоўчага або адмоўнага зарада ў атаме.
Для канкрэтнасці разгледзім праходжанне высакахуткасных α-часціц праз атам, які мае станоўчы цэнтральны зарад N e і акружаны кампенсавальным зарадам з N электронамі.[1]
Мадэль Рэзерфорда служыла для канцэнтрацыі вялікай колькасці зараду і масы атама на вельмі малым ядры, але не адносіла аніводнай структуры да астатніх электронаў і астатняй атамнай масе. У ім згадваецца атамная мадэль Хантара Нагаока, у якой электроны размешчаны ў адным ці некалькіх кольцах са спецыфічнай метафарычнай структурай стабільных кольцаў Сатурна. Мадэль Дж. Дж. Томсана таксама мела кольцы з арбітальных электронаў. Жан Батыст Перэн у сваёй нобелеўскай лекцыі[3] сцвярджаў, што ён першым прапанаваў мадэль у сваёй працы ад 1901 года.
У артыкуле Рэзерфорда выказана здагадка, што цэнтральны зарад атама можа быць «прапарцыйным» яго атамнай масе ў адзінках масы вадароду u (прыкладна 1/2 ад яго ў мадэлі Рэзерфорда). Што тычыцца золата, масавы лік 197 (тады не было вядома з вялікай дакладнасцю), і таму, паводле мадэлі Рэзерфарда можа скласці 196. Аднак Рэзерфорд не спрабаваў прама злучыць цэнтральны зарад з атамным нумарам, паколькі «атамны нумар» золата (на той момант проста яго нумар у перыядычнай табліцы) складаў 79, а Рэзерфорд змадэляваў зарад прыблізна + 100 адзінак (ён фактычна прапанаваў 98 адзінак станоўчага зарада, каб зрабіць палову 196 г.) Такім чынам, Рэзерфард фармальна не мяркуе, што два нумары (месца перыядычнай табліцы, 79, і ядзерны зарад, 98 або 100) могуць быць сапраўды аднолькавымі.
Праз месяц пасля з’яўлення дакумента Рэзерфорда, Антоніус ван дэн Брук выступіў з прапановай адносна дакладнай ідэнтыфікацыі атамнага нумара і ядзернага зарада, а потым праз два гады эксперыментальна пацвердзіў Генры Мозелі.
Гэта асноўныя паказчыкі-
- Электроннае воблака атама не ўплывае на рассейванне альфа-часціц.
- Значная частка станоўчага зарада атама сканцэнтравана ў адносна малюсенькім аб’ёме ў цэнтры атама, які сёння вядомы як ядро. Велічыня гэтага зарада прапарцыйная (да колькасці зарада, які можа быць прыблізна паловай) атамнай масы атама — астатняя маса, як вядома, у асноўным прыпісваецца нейтронам. Гэтая канцэнтраваная цэнтральная маса і зарада нясуць адказнасць за адхіленне як альфа-, так і бэта-часціц.
- Маса цяжкіх атамаў, такіх як золата, у асноўным канцэнтруецца ў цэнтральнай вобласці зарада, паколькі разлікі паказваюць, што яна не адхіляецца і не рухаецца альфа-часціцамі высокай хуткасці, якія маюць вельмі вялікі імпульс у параўнанні з электронамі, але не адносна цяжкіх атамаў у цэлым.
- Сам атам прыблізна ў 100 000 (105) разоў перавышае дыяметр ядра[4]. Гэта можа быць звязана з кладкай пяску ў сярэдзіне футбольнага поля.[5]
Уклад у сучасную навуку[правіць | правіць зыходнік]
Пасля адкрыцця Рэзерфорда навукоўцы пачалі разумець, што атам не з’яўляецца ў канчатковым выніку адзінай часціцай, а складаецца са значна меншых субатамных часціц. Наступныя даследаванні вызначылі дакладную структуру атама, што прывяло да эксперыменту залатой фольгі Рэзерфорда. Навукоўцы ў рэшце выявілі, што атамы маюць у цэнтры станоўча зараджанае ядро (з дакладнай атамнай колькасцю зарадаў) з радыусам каля 1.2 × 10−15 метраў × [атамная маса]1⁄3. Электронаў аказалася яшчэ менш.
Пазней навукоўцы знайшлі чаканую колькасць электронаў (тое ж самае, што атамны нумар) у атаме пры дапамозе рэнтгенаўскага выпраменьвання. Калі рэнтген праходзіць праз атам, частка яго рассейваецца, а астатняя частка праходзіць праз атам. Паколькі рэнтген губляе інтэнсіўнасць, перш за ўсё, дзякуючы рассейванню на электронах, можна дакладна ацаніць колькасць электронаў у атаме, адзначаючы хуткасць зніжэння інтэнсіўнасці рэнтгенаўскага выпраменьвання.[1]
Сімвалізм[правіць | правіць зыходнік]
Глядзіце таксама: Бораўская мадэль атама
Мадэль Рэзерфорда адкладзена да ідэі шматлікіх электронаў у кольцах, на Нагаока. Аднак, як толькі Нільс Бор змяніў гэты погляд на карціну толькі некалькіх электронаў, падобных на планету, для светлавых атамаў, мадэль Рэзерфорда — Бора захапіла фантазію грамадскасці. З таго часу яна пастаянна выкарыстоўваецца як сімвал атамаў і нават для «атамнай» энергіі (хоць гэта больш правільна лічыцца ядзернай энергіяй). Прыклады яго выкарыстання за мінулае стагоддзе ўключаюць, але не абмяжоўваюцца імі:
- Лагатып Камісіі па атамнай энергіі ЗША, які часткова адказваў за яго далейшае выкарыстанне ў сувязі з тэхналогіямі дзялення ядра, у прыватнасці.
- Сцяг Міжнароднага агенцтва па атамнай энергіі — атам Рэзерфорда, заключаны ў галінках масліны еўрапейскай.
- Лагатып бейсболу другаснай лігі ЗША Альбукерке Ізатопы — атам Рэзерфорда, а арбіты электронаў утвараюць А.
- Падобны сімвал, атамны віх, быў абраны сімвалам для амерыканскіх атэістаў і стаў выкарыстоўвацца як сімвал Атэізм ў цэлым.
- У кодавай табліцы Унікод Розныя сімвалы U + 269B (⚛) выкарыстоўваецца атам Рэзерфорда[1].
- Тэлешоў «Тэорыя Вялікага выбуху» выкарыстоўвае атам Рэзерфорда.
- На картах звычайна выкарыстоўваецца для абазначэння ядзернай энергетычнай устаноўкі.
Зноскі
- ↑ а б в г д Rutherford E. The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine. Series 6, vol. 21. May 1911
- ↑ Bryson, Bill (2003-05-06). A Short History of Nearly Everything. Broadway Books. ISBN 0767908171.
{{cite book}}: Пададзена больш чым адно значэнне|ISBN=і|isbn=specified (даведка) - ↑ 1926 Lecture for Nobel Prize in Physics
- ↑ Nicholas Giordano (1 January 2012). College Physics: Reasoning and Relationships. Cengage Learning. pp. 1051-. ISBN 1-285-22534-1.
- ↑ Constan, Zach (2010). «Learning Nuclear Science with Marbles». The Physics Teacher. 48 (2): 114. Bibcode:2010PhTea..48..114C. doi:10.1119/1.3293660.
