Серная кіслата: Розніца паміж версіямі
| [недагледжаная версія] | [дагледжаная версія] |
Змесціва выдалена Змесціва дададзена
+Катэгорыя:Сульфаты; +Катэгорыя:Неарганічныя кіслоты; +Катэгорыя:Злучэнні серы; +Катэгорыя:Атрутныя рэчывы; +[[Катэгорыя:Харчов... |
Няма тлумачэння праўкі |
||
| Радок 1: | Радок 1: | ||
{{Рэчыва |
|||
| загаловак = Серная кіслата |
|||
| карцінка = Sulfuric-acid-2D-dimensions.svg |
|||
| карцінка3D = Sulfuric-acid-3D-vdW.png |
|||
| карцінка малая = Sulfuric_acid_chemical_structure.png |
|||
| найменне = серная кіслата |
|||
| традыцыйныя назвы = |
|||
| скарачэнні = |
|||
| хім. формула = H<sub>2</sub>SO<sub>4</sub> |
|||
| эмпірычная формула = |
|||
| адн. малек. маса = 98,082 |
|||
| малярная маса = 98,082 |
|||
| шчыльнасць = 1,8356 |
|||
| мяжа трываласці = |
|||
| цвёрдасць = |
|||
| прымясі = |
|||
| стан = вадкасць |
|||
| дынамічная вязкасць = |
|||
| кінематычная вязкасць = |
|||
| тэмп. плаўлення = -10,38*З |
|||
| тэмп. кіпення = 279,6*З |
|||
| тэмп. раскладання = |
|||
| тэмп. успышкі = |
|||
| тэмп. узгарання = не ўзгарэцца |
|||
| тэмп. самазагарання = |
|||
| патройны пункт = |
|||
| крытычны пункт = |
|||
| цеплаёмістасць = |
|||
| цеплаёмістасць2 = |
|||
| цеплаправоднасць = |
|||
| энтальпія ўтварэння = |
|||
| удзельная цеплыня параўтварэння = |
|||
| удзельная цеплыня плаўлення = 10,73 |
|||
| цеплавое пашырэнне = |
|||
| інтэрвал трансфармацыі = |
|||
| тэмпература размякчэння = |
|||
| ціск пары = |
|||
| канст. дысац. кіслаты = -3 |
|||
| растваральнасць = змешваецца |
|||
| растваральнасць = |
|||
| рэчыва1 = |
|||
| растваральнасць2 = |
|||
| рэчыва2 = |
|||
| растваральнасць3 = |
|||
| рэчыва3 = |
|||
| растваральнасць4 = |
|||
| рэчыва4 = |
|||
| вярчэнне = |
|||
| ізаэлектрычны пункт = |
|||
| дыяпазон празрыстасці = |
|||
| паказчык пераламлення = 1.397 |
|||
| вугал Брустэра = |
|||
| гібрыдызацыя = |
|||
| кардынацыйная геаметрыя = |
|||
| крышталічная структура = |
|||
| дыпольны момант = 2.72 |
|||
| CAS = 7664-93-9 |
|||
| EINECS = |
|||
| SMILES = |
|||
| ЕС = 231-639-5 |
|||
| RTECS = WS5600000 |
|||
| ЛД50 = 510 |
|||
| таксічнасць = {{NFPA 704 |
|||
| небяспека для здароўя = 3 |
|||
| вогненебяспечнасць = 0 |
|||
| рэакцыёназдольнасць = 2 |
|||
| іншае = <s>W</s> |
|||
}} |
|||
[[Выява:Hazard C.svg|80px]] |
|||
}} |
|||
'''Серная кіслата''' H<sub>2</sub>SO<sub>4</sub> — моцная двухасноўная [[кіслата]], якая адпавядае вышэйшай ступені акіслення серы (6). Пры звычайных умовах канцэнтраваная серная кіслата — цяжкая алеістая вадкасць без колеру і паху. У тэхніцы сернай кіслатой называюць яе сумесі з [[вада|вадой]], так і з серным ангідрыдам SO3. Калі малярныя адносіны SO<sub>3</sub>:H<sub>2</sub>O < 1, то гэта водны раствор сернай кіслаты, калі> 1, — раствор SO<sub>3</sub> ў сернай кіслаце (олеум). |
'''Серная кіслата''' H<sub>2</sub>SO<sub>4</sub> — моцная двухасноўная [[кіслата]], якая адпавядае вышэйшай ступені акіслення серы (6). Пры звычайных умовах канцэнтраваная серная кіслата — цяжкая алеістая вадкасць без колеру і паху. У тэхніцы сернай кіслатой называюць яе сумесі з [[вада|вадой]], так і з серным ангідрыдам SO3. Калі малярныя адносіны SO<sub>3</sub>:H<sub>2</sub>O < 1, то гэта водны раствор сернай кіслаты, калі> 1, — раствор SO<sub>3</sub> ў сернай кіслаце (олеум). |
||
{{Растваральнасць кіслот, заснаванняў і соляў у вадзе}} |
|||
{{Сульфаты}} |
|||
[[Катэгорыя:Сульфаты]] |
[[Катэгорыя:Сульфаты]] |
||
Версія ад 20:37, 1 лістапада 2011
| Серная кіслата | |
| |

| |

| |
| Агульныя | |
|---|---|
| Сістэматычнае найменне | серная кіслата |
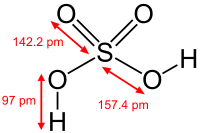
| Хім. формула | H2SO4 |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | вадкасць |
| Адн. малек. маса | 98,082 а. а. м. |
| Малярная маса | 98,082 г/моль |
| Шчыльнасць | 1,8356 г/см³ |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | -10,38*З °C |
| Тэмпература кіпення | 279,6*З °C |
| Тэмпература ўзгарання | не ўзгарэцца °C |
| Удзельная цеплыня плаўлення | 10,73 Дж/кг |
| Хімічныя ўласцівасці | |
| pKa | -3 |
| Аптычныя ўласцівасці | |
| Паказчык пераламлення | 1.397 |
| Структура | |
| Дыпольны момант | 2.72 Д |
| Класіфікацыя | |
| Рэг. нумар CAS | |
| PubChem | |
| Рэг. нумар EINECS | 231-639-5 |
| SMILES | |
| Рэг. нумар EC | 231-639-5 |
| RTECS | WS5600000 |
| ChemSpider | |
| Бяспека | |
| ЛД50 | 510 мг/кг |
| Таксічнасць |
|
Серная кіслата H2SO4 — моцная двухасноўная кіслата, якая адпавядае вышэйшай ступені акіслення серы (6). Пры звычайных умовах канцэнтраваная серная кіслата — цяжкая алеістая вадкасць без колеру і паху. У тэхніцы сернай кіслатой называюць яе сумесі з вадой, так і з серным ангідрыдам SO3. Калі малярныя адносіны SO3:H2O < 1, то гэта водны раствор сернай кіслаты, калі> 1, — раствор SO3 ў сернай кіслаце (олеум).


