Серная кіслата: Розніца паміж версіямі
| [дагледжаная версія] | [дагледжаная версія] |
Змесціва выдалена Змесціва дададзена
др Адкат версіі 3847063 аўтарства 91.213.187.118 (размова) Тэг: Адмена |
Няма тлумачэння праўкі |
||
| Радок 78: | Радок 78: | ||
== Літаратура == |
== Літаратура == |
||
* {{Крыніцы/БелЭн|том=14}} |
|||
* {{кніга|загаловак=Беларуская энцыклапедыя: У 18 т. Т.14: Рэле — Слаявіна|адказны=Рэдкал.: Г. П. Пашкоў і інш|месца=Мн.|выдавецтва=БелЭн|год=2002|том=14|старонак=512|isbn=985-11-0238-5 (Т. 14)|тыраж=10 000}} |
|||
{{Растваральнасць кіслот, асноваў і соляў у вадзе}} |
|||
{{Сульфаты}} |
{{Сульфаты}} |
||
Версія ад 07:47, 17 жніўня 2021
| Серная кіслата | |
| |

| |

| |
| Агульныя | |
|---|---|
| Сістэматычнае найменне | серная кіслата |
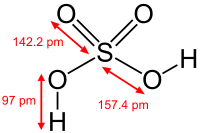
| Хім. формула | H2SO4 |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | вадкасць |
| Малярная маса | 98,082 г/моль |
| Шчыльнасць | 1,8356 г/см³ |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | 10,38 °C |
| Тэмпература кіпення | 338,8 °C |
| Тэмпература ўзгарання | не ўзгараецца °C |
| Удзельная цеплыня плаўлення | 10,73 Дж/кг |
| Хімічныя ўласцівасці | |
| pKa | –3 |
| Аптычныя ўласцівасці | |
| Паказчык пераламлення | 1,397 |
| Структура | |
| Дыпольны момант | 2,72 Д |
| Класіфікацыя | |
| Рэг. нумар CAS | |
| PubChem | |
| Рэг. нумар EINECS | 231-639-5 |
| SMILES | |
| Рэг. нумар EC | 231-639-5 |
| RTECS | WS5600000 |
| ChemSpider | |
| Бяспека | |
| ЛД50 | 510 мг/кг |
| Таксічнасць | 
|
Серная кіслата H2SO4 — моцная двухасноўная кіслата, якая адпавядае вышэйшай ступені акіслення серы (+6). Пры звычайных умовах канцэнтраваная серная кіслата — цяжкая алеістая вадкасць без колеру і паху. У тэхніцы сернай кіслатой называюць яе сумесі з вадой, так і з серным ангідрыдам SO3. Калі малярныя адносіны SO3:H2O < 1, то гэта водны раствор сернай кіслаты, калі > 1, — раствор SO3 ў сернай кіслаце (олеум).
Літаратура
- Беларуская энцыклапедыя: У 18 т. Т. 14: Рэле — Слаявіна / Рэдкал.: Г. П. Пашкоў і інш. — Мн. : БелЭн, 2002. — Т. 14. — 512 с. — 10 000 экз. — ISBN 985-11-0035-8. — ISBN 985-11-0238-5 (т. 14).

