Дэлецыя (генетыка)

У генетыцы дэлецыя (знак: Δ) — гэта мутацыя (генетычная аберацыя), пры якой частка храмасомы або паслядоўнасць ДНК застаецца не падвоенай падчас рэплікацыі ДНК. Можа быць выдалена любая колькасць нуклеатыдаў, ад адной асновы да цэлай часткі храмасомы.[1] Некаторыя храмасомы маюць ломкія месцы, дзе адбываюцца разрывы, што прыводзіць да выдалення часткі храмасомы. Разрывы могуць быць выкліканы высокай тэмпературай, вірусамі, радыяцыяй або хімічнымі рэакцыямі.[2]
Для ўзнікнення сінапсісу паміж храмасомай з вялікай інтэркалярнай дэлецыяй і нармальным поўным гамолагам няпарная вобласць нармальнага гамолага павінна выйсці з лінейнай структуры ў кампенсаторную пятлю або пятлю выдалення.
Найменшыя мутацыі з дэлецыяй адной пары нуклеатыдаў ўзнікаюць у выніку перавароту асноў ДНК ў ДНК-матрыцы з наступным саслізгваннем ланцуга ДНК у актыўным цэнтры ДНК-палімеразы.[3][4][5]
Дэлецыя можа быць выклікана памылкамі храмасомнага красінговеру падчас меёзу, што выклікае некалькі сур’ёзных генетычных захворванняў. Дэлецыі характэрныя для эукарыётычных арганізмаў, у тым ліку чалавека.
Прычыны[правіць | правіць зыходнік]
Прычыны дэлецый наступныя:
- Страты ад транслакацыі
- Храмасомныя красінговеры ў межах храмасомнай інверсіі
- Няроўны красінговер
- Разрывы ДНК без рэпаратыўнага ўз’яднання
Тыпы[правіць | правіць зыходнік]
Тыпы дэлецый наступныя:
- Канцавая (тэрмінальная) дэлецыя — дэлецыя, якая адбываецца да канца храмасомы.
- Унутраная (інтэркалярная) дэлецыя — дэлецыя, якая адбываецца ўнутры храмасомы.
- Мікрадэлецыя — адносна невялікая дэлецыя (да 5 Мб, якая можа ўключаць дзясятак генаў).
Мікрадэлецыя звычайна выяўляецца ў дзяцей з фізічнымі адхіленнямі. Вялікая колькасць дэлецый можа прывесці да неадкладнага аборту (выкіду).
Наменклатура[правіць | правіць зыходнік]

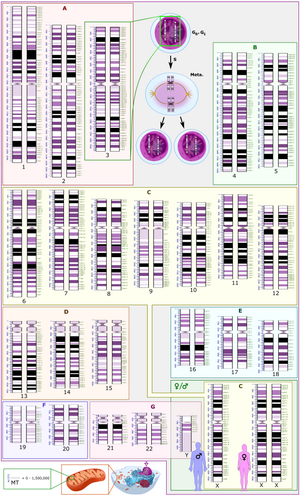
Міжнародная сістэма цытагенамічнай наменклатуры чалавека (ISCN) — гэта міжнародны стандарт наменклатуры храмасом чалавека, які ўключае назвы палос (бэндаў), сімвалы і скарочаныя тэрміны, якія выкарыстоўваюцца пры апісанні храмасом чалавека і анамалій храмасом. Выкарыстоўваюцца абрэвіятуры знак мінус (-) для дэлецыі храмасомы і del для дэлецыі частак храмасомы.[7]
Эфекты[правіць | правіць зыходнік]
Невялікія дэлецыі радзей прыводзяць да смяротнага зыходу, вялікія дэлецыі звычайна фатальныя — заўсёды ёсць варыяцыі, у залежнасці ад якіх гены губляюцца. Некаторыя дэлецыі сярэдняга памеру прыводзяць да вядомых захворванняў чалавека, напрыклад, сіндрому Уільямса.
Дэлецыя колькасці пар нуклеатыдаў, якое нераўнамерна дзеліцца на тры, прывядзе да мутацыі зруху рамкі счытвання, у выніку чаго ўсе кадоны, якія ўзнікаюць пасля выдалення, будуць няправільна счытвацца падчас трансляцыі, утвараючы сур’ёзна зменены і патэнцыйна нефункцыянальны бялок. Наадварот, дэлецыя, якая раўнамерна дзеліцца на тры, называецца in-frame дэлецыяй.[8]
Дэлецыі адказваюць за шэраг генетычных парушэнняў, у тым ліку некаторыя выпадкі мужчынскага бясплоддзя, дзве траціны выпадкаў мышачнай дыстрафіі Дзюшэна[1] і дзве траціны выпадкаў мукавісцыдозу (выкліканага ΔF508).[9] Выдаленне часткі кароткага пляча 5 храмасомы прыводзіць да сіндрому кашынага крыку.[1] Дэлецыі ў гене, які кадуе SMN, выклікаюць спінальную мышачную атрафію, найбольш распаўсюджаную генетычную прычыну смерці немаўлят.
Мікрадэлецыі звязаны з мноствам розных захворванняў, у тым ліку з сіндромам Ангельмана, сіндромам Прадэра-Вілі і сіндромам Ды Джорджа.[10] Некаторыя сіндромы, у тым ліку сіндром Ангельмана і сіндром Прадэра-Вілі, звязаны як з мікрадэлецыямі, так і з геномным імпрынтынгам, што азначае, што адна і тая ж мікрадэлецыя можа выклікаць два розныя сіндромы ў залежнасці ад таго, у каго з бацькоў адбылася дэлецыя.[11]
Апошнія даследаванні паказваюць, што некаторыя дэлецыі высокакансерватыўных паслядоўнасцей (CONDEL) могуць быць адказнымі за эвалюцыйныя адрозненні, прысутныя паміж блізкароднаснымі відамі. Такія дэлецыі ў людзей, якія называюцца hCONDEL, могуць быць адказнымі за анатамічныя і паводніцкія адрозненні паміж людзьмі, шымпанзэ і іншымі відамі млекакормячых, такімі як гаміноіды або малпы.[12]
Нядаўняя ўсёабдымная класіфікацыя пацыентаў і колькасная ацэнка фактараў, якія выклікаюць развіццё пухліны, у кагортах TCGA паказалі, што на пухліну прыпадае ў сярэднім 12 фактараў, якія выклікаюць пухліну, з якіх 2,1 з’яўляюцца дэлецыямі анка-супрэсараў.[13]
Дэлецыі мітахандрыяльнай ДНК[правіць | правіць зыходнік]
У дражджах Saccharomyces cerevisiae ядравыя гены Rad51p, Rad52p і Rad59p кадуюць бялкі, неабходныя для рэкамбінацыйнай рэпарацыі і выкарыстоўваюцца ў аднаўленні двухланцуговых разрываў у мітахандрыяльнай ДНК.[14] Страта гэтых бялкоў зніжае верагоднасць спантанных дэлецый ДНК у мітахондрыях.[14]
Гл. таксама[правіць | правіць зыходнік]
- Індэл
- Храмасомныя анамаліі
- Нулявы алель
- Спіс генетычных парушэнняў
- Медыцынская генетыка
- Мікрадэлецыйны сіндром
- Інсерцыя (генетыка)
- Дэлецыя 10q26
Крыніцы[правіць | правіць зыходнік]
- ↑ а б в Lewis, R. (2004). Human Genetics: Concepts and Applications (6th ed.). McGraw Hill. ISBN 978-0072951745.
- ↑ Klug, William S. (2015). Concepts of genetics. Michael R. Cummings, Charlotte A. Spencer, Michael Angelo Palladino (Eleventh ed.). Boston. ISBN 978-0-321-94891-5. OCLC 880404074.
- ↑ Banavali, Nilesh K. (2013). "Partial Base Flipping is Sufficient for Strand Slippage near DNA Duplex Termini". Journal of the American Chemical Society. 135 (22): 8274–8282. doi:10.1021/ja401573j. PMID 23692220.
- ↑ Banavali, Nilesh K. (2013). "Partial Base Flipping is Sufficient for Strand Slippage near DNA Duplex Termini". Journal of the American Chemical Society. 135 (22): 8274–8282. doi:10.1021/ja401573j. PMID 23692220.
- ↑ Manjari, Swati R.; Pata, Janice D.; Banavali, Nilesh K. (2014). "Cytosine Unstacking and Strand Slippage at an Insertion–Deletion Mutation Sequence in an Overhang-Containing DNA Duplex". Biochemistry. 53 (23): 3807–3816. doi:10.1021/bi500189g. PMC 4063443. PMID 24854722.
- ↑ Warrender JD, Moorman AV, Lord P (2019). "A fully computational and reasonable representation for karyotypes". Bioinformatics. 35 (24): 5264–5270. doi:10.1093/bioinformatics/btz440. PMC 6954653. PMID 31228194.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) — «This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/)» - ↑ ISCN Symbols and Abbreviated Terms. Coriell Institute for Medical Research. Праверана 27 кастрычніка 2022.
- ↑ LSDB — Controlled vocabulary terms Архівавана 6 кастрычніка 2011 года. at The GEN2PHEN Knowledge Centre. Posted Fri, 08/01/2010.
- ↑ Mitchell, Richard Sheppard; Kumar, Vinay; Robbins, Stanley L.; Abbas, Abul K.; Fausto, Nelson (2007). Robbins basic pathology. Saunders/Elsevier. ISBN 978-1-4160-2973-1.
- ↑ Srour, Myriam; Shevell, Michael (2015-01-01). Rosenberg, Roger N.; Pascual, Juan M. (рэд-ры). Chapter 14 - Global Developmental Delay and Intellectual Disability. Rosenberg's Molecular and Genetic Basis of Neurological and Psychiatric Disease (Fifth Edition) [англійская]. Boston: Academic Press. pp. 151–161. ISBN 978-0-12-410529-4. Праверана 2022-01-07.
- ↑ Kalsner, Louisa; Chamberlain, Stormy J. (April 22, 2015). "Prader-Willi, Angelman, and 15q11-q13 duplication syndromes". Pediatric Clinics of North America. 62 (3): 587–606. doi:10.1016/j.pcl.2015.03.004. ISSN 0031-3955. PMC 4449422. PMID 26022164.
- ↑ McLean CY, Reno PL, Pollen AA, Bassan AI, Capellini TD, Guenther C, Indjeian VB, Lim X, Menke DB, Schaar BT, Wenger AM, Bejerano G, Kingsley DM (March 2011). "Human-specific loss of regulatory DNA and the evolution of human-specific traits". Nature. 471 (7337): 216–9. Bibcode:2011Natur.471..216M. doi:10.1038/nature09774. PMC 3071156. PMID 21390129.
- ↑ Vyatkin, Alexey D.; Otnyukov, Danila V.; Leonov, Sergey V.; Belikov, Aleksey V. (14 January 2022). "Comprehensive patient-level classification and quantification of driver events in TCGA PanCanAtlas cohorts". PLOS Genetics. 18 (1): e1009996. doi:10.1371/journal.pgen.1009996. PMC 8759692. PMID 35030162.
- ↑ а б Ivanetich, K. M.; Lucas, S.; Marsh, J. A.; Ziman, M. R.; Katz, I. D.; Bradshaw, J. J. (1978). "Organic compounds. Their interaction with and degradation of hepatic microsomal drug-metabolizing enzymes in vitro". Drug Metabolism and Disposition: The Biological Fate of Chemicals. 6 (3): 218–225. PMID 26540.
