Рак падстраўнікавай залозы
| Рак падстраўнікавай залозы | |
|---|---|
 | |
| МКБ-10-КМ | C25.0, C25.1 і C25.2 |
| МКБ-9-КМ | 157.1[1], 157.8[1], 157.0[1] і 157.2[1] |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |

Рак падстраўнікавай залозы (РПЗ) з’яўляецца, калі клеткі ў падстраўнікавай залозе (падстраўніцы), жалезістым органе за страўнікам, пачынаюць безкантрольна памнажацца і ўтвараюць масу. Гэтыя ракавыя клеткі здольныя распаўсюджвацца ў іншыя органы цела[2]. Існуе шэраг відаў РПЗ. Найбольш распаўсюджаны — адэнакарцынома падстраўнікавай залозы, ён складае каля 90 % выпадкаў[3]. Панятак «рак падстраўнікавай залозы» часам выкарыстоўваецца для абазначэння толькі гэтага тыпу[4]. Гэтыя адэнакарцыномы з’яўляюцца ў той частцы падстраўнікавай залозы, якая вырабляе стрававальныя ферменты[4]. Некалькі іншых відаў рака, якія ў сукупнасці ўяўляюць большасць не-аденакарцыном, таксама могуць пачынацца з тых самых клетак[4]. Адзін ці два адсоткі выпадкаў РПЗ складаюць нейраэндакрынныя пухліны, якія ўзнікаюць з клетак, якія выпрацоўваюць гармоны падстраўнікавай залозы[4]. Звычайна яны менш агрэсіўныя, чым адэнакарцынома падстраўнікавай залозы[4].
Прыкметамі і сімптомамі найбольш распаўсюджанай формы РПЗ могуць быць пажаўцелая скура, болі ў жываце і спіне, невытлумачальная страта вагі, кал светлага колеру, цёмная мача і страта апетыту[5]. Звычайна на ранніх стадыях захворвання няма заўважных сімптомаў, а спецыфічныя сімптомы, па якіх можна зрабіць здагадку аб РПЗ, звычайна не развіваюцца да часу, калі хвароба ўжо развілася да прасунутай стадыі[5][6]. У многіх выпадках дыягназ РПЗ ўстанаўліваецца, калі пухліна ўжо распаўсюдзілася на іншыя органы цела[4][7].
РПЗ звычайна дыягнастуецца спалучэннем медыцынскіх метадаў візуалізацыі (напрыклад ультрагукавая і камп’ютарная тамаграфія), аналізу крыві і даследаваннем тканкавых узораў (біяпсія)[8][9]. Хвароба дзеліцца на стадыі: ад ранняй (I стадыя) да позняй (стадыя IV)[7]. Скрынінг - масавае папераджальнае абследаванне насельніцтва - не быў прызнаны эфектыўным[10].
РПЗ рэдка сустракаецца ва ўзросце да 40 гадоў, і больш за палову выпадкаў адэнакарцыномы падстраўнікавай залозы сустракаецца ў асоб старэйшых за 70 гадоў[6]. Фактары рызыкі РПЗ ўключаюць паленне тытуню, атлусценне, дыябет і некаторыя рэдкія генетычныя захворванні[6]. Каля 25 % выпадкаў звязана з паленнем[8], а 5-10 % звязана з спадчыннымі генамі[6]. Рызыка захварэць на РПЗ ніжэй як сярод тых, хто не паліць, так і ў людзей, якія падтрымліваюць здаровую вагу і абмяжоўваюць спажыванне чырвонага і апрацаванага мяса[11]. Рызыка захварэць у тых, хто паліць, змяншаецца пасля кідання палення і становіцца прыблізна аднолькавай з сярэднім паказнікам для ўсяго насельніцтва пасля 20 гадоў[4].
РПЗ лечыцца хірургічным шляхам, прамянёвай тэрапіяй, хіміятэрапіяй, паліятыўнай тэрапіяй і іх камбінацыямі[5]. Варыянты лячэння збольшага залежаць на стадыі рака[5]. Хірургія — адзіны метад, які можа вылечыць адэнакарцыному падстраўнікавай залозы[7]. Ён таксама ўжываецца для паляпшэння якасці жыцця, калі выздараўленне немагчыма[5][7]. Барацьба з болем і лекі для паляпшэння стрававання часам неабходныя для хворых на РПЗ[7]. Ранняя паліятыўная дапамога рэкамендуецца нават тым, хто праходзіць лячэнне з мэтай выздараўлення[12], але не практыкуецца ў Беларусі.
РПЗ можа распаўсюджвацца на іншыя органы. Звычайна адэнакарцынома падстраўнікавай залозы спачатку распаўсюджваецца ў найбліжэйшыя пасакавыя вузлы, а потым у печань альбо ў брухавінавую паражніну, тоўстую кішку ці лёгкія[8]. РПЗ рэдка распаўсюджваецца ў косткі ці мозг[13].
РПЗ можа быць другасным ракам, які распаўсюдзіўся з іншых частак цела. Гэта здараецца рэдка, толькі каля 2 % РПЗ з’яўляюцца другаснымі. На сённяшні дзень рак ныркі з’яўляецца найбольш распаўсюджаным ракам, які выклікае другасны РПЗ, за ім ідуць рак простай кішкі, скуры, малочнай залозы і лёгкіх. У выпадках другаснага РПЗ хірургічнае ўмяшанне можа быць праводзіцца на падстраўнікавай залозе з мэтай ацалення альбо аблягчэння сімптомаў[14].
У 2015 годзе РПЗ усіх тыпаў прывёў да 411 600 смерцяў у свеце[15]. РПЗ — пятая па частаце прычына смерці ад раку ў Вялікабрытаніі[16] і трэцяя па распаўсюджанасці ў ЗША[17]. Захворванне сустракаецца часцей за ўсё ў развітых краінах, дзе было зафіксавана каля 70 % новых выпадкаў у 2012 годзе[4]. Адэнакарцынома падстраўнікавай залозы звычайна мае вельмі кепскі прагноз на выздараўленне: пасля афірматыўнага дыягназу 25 % людзей жывуць цягам году, 5 % пражываюць пяць гадоў[4]. Для захворванняў, дыягнаставаных на ранніх стадыях, верагоднасць выжывання цягам пяці гадоў павялічваецца да прыблізна 20 %[18]. Нейраэндакрынны рак мае лепшы прагноз: пасля афірматыўнага дыягназу 65 % дыягнаставаных жывуць пяць гадоў; гэты паказнік значна розніцца ў залежнасці ад тыпу пухліны[4].
Тыпы[правіць | правіць зыходнік]
Шматлікія тыпы РПЗ можна падзяліць на дзве агульныя групы. Пераважная большасць выпадкаў (каля 95 %) сустракаецца ў той частцы падстраўнікавай залозы, якая выпрацоўвае стрававальныя ферменты, вядомыя як экзакрынны вытвор (сакрэт). Існуе некалькі падтыпаў экзакрынных ракаў падстраўнікавай залозы, іх дыягностыка і лячэнне маюць шмат агульнага. Нязначная меншасць ракавых пухлін, якія ўзнікаюць у гармонастваральнай (эндакрыннай) тканцы падстраўнікавай залозы, маюць розныя клінічныя характарыстыкі і называюцца нейраэндакрынными карцыномамі (пухлінамі) падстраўнікавай залозы. Абедзве групы сустракаюцца галоўным чынам, але не выключна, у людзей, старэйшых за 40 гадоў, і крыху часцей — у мужчын, аднак некаторыя рэдкія падтыпы сустракаюцца часцей у жанчын або дзяцей[19][20].
Экзакрынныя карцыномы[правіць | правіць зыходнік]
У экзакрыннай групе пераважае адэнакарцынома падстраўнікавай залозы — найбольш распаўсюджаны тып (каля 85 %) РПЗ[6]. Амаль усе яны пачынаюцца ў пратоках падстраўнікавай залозы як пратокавая адэнакарцынома[21]. Гэта пры тым, што тканка, з якой карцынома ўзнікае — эпітэлій пратокі падстраўнікавай залозы — складае менш за 10 % аб’ёму клетак падстраўнікавай залозы, бо ўяўляе сабой толькі пратоку (разгалінаваная, капілярная сістэма пратокаў, якая выходзіць навонкі залозы) унутры падстраўнікавай залозы[22]. Гэты рак бярэ пачатак у пратоках, якія выносяць вытворы (напрыклад, ферменты і бікарбанат) навонкі падстраўнікавай залозы. Каля 60-70 % адэнакарцыном сустракаецца ў галоўцы падстраўнікавай залозы[6].
Наступны па распаўсюджанасці тып, ацынарнаклеткавая карцынома падстраўнікавай залозы, узнікае ў кластарах клетак, якія выпрацоўваюць ферменты, і складае 5 % экзакрынных РПЗ[23]. Як і «функцыянуючыя» эндакрынныя ракі, апісаныя ніжэй, ацынарнаклеткавая карцыномы здольныя выклікаць празмерны выраб пэўных малекул, у дадзеным выпадку — стрававальных ферментаў, якія могуць праяўляць сябе ў такіх сімптомах, як сып на скуры і боль у суставах.
На цыстаадэнакарцыномы прыпадае 1 % РПЗ, і яны маюць лепшы прагноз, чым іншыя экзакрынныя тыпы[23].
Панкрэатабластома з’яўляецца рэдкай формай. Збольшага яна сустракаецца ў дзіцячым узросце і мае адносна добры прагноз. Солідная псеўдапапілярная карцынома — рэдкае добраакрэсленае новаўтварэнне, які ў асноўным сустракаецца ў маладых жанчын і звычайна мае вельмі добры прагноз[6][6][24].
Муцынозныя кістозныя неаплазіі (новаўтварэнні; MCNs) — гэта шырокая група пухлін падстраўнікавай залозы, якія маюць розны злаякасны патэнцыял. Яны выяўляюцца з усё большай хуткасцю, бо камп’ютарная тамаграфія становіцца больш магутнай і даступнай. Абмеркаванне найлепных шляхоў іх ацэнкі і лячэння актыўна працягваецца з улікам таго, што многія з іх — дабраякасныя[25].
Нейраэндакрынныя карцыномы[правіць | правіць зыходнік]
Нязначная прапорцыя пухлін узнікае ў іншых частках падстраўнікавай залозы; у асноўным гэта нейраэндакрынныя пухліны падстраўнікавай залозы[26]. Нейраэндакрынныя пухліны — гэта тып шматлікіх дабраякасных і злаякасных пухлін, якія ўзнікаюць з нейраэндакрынных клетак арганізма, што адказваюць за ўзаемадзеянне нервовай і эндакрыннай сістэм. Яны могуць з’яўляцца ў большасці органаў цела, у тым ліку падстраўнікавай залозе, аднак злаякасныя тыпы лічацца рэдкімі. Сярод нейраэндакрынных пухлін падстраўнікавай залозы адрозніваюць «функцыянуючыя» і «нефункцыянуючыя» тыпы — у залежнасці ад выпрацоўкі гармонаў. Функцыянуючыя пухліны вылучаюць у кроў гармоны, напрыклад інсулін, гастрын і глюкагон, часта ў вялікіх колькасцях, што выклікае сур’ёзныя сімптомы, такія як нізкі ўзровень цукру ў крыві, што дазваляе выяўляць гэтыя пухліны параўнальна рана. Найбольш распаўсюджаныя нейраэндакрынныя пухліны падстраўнікавай залозы — інсуліномы і гастрыномы, названыя ў сувязі з гармонамі, якія яны вылучаюць. Нефункцыянуючыя тыпы не вылучаюць гармоны ў колькасці, дастатковай для з’яўлення відавочных клінічных сімптомаў. Па гэтай прычыне нефункцыянуючыя нейраэндакрынныя пухліны падстраўнікавай залозы часта дыягнастуюцца толькі пасля таго, як рак распаўсюдзіўся на іншыя часткі цела[27].
Як і з іншымі нейраэндакрыннымі пухлінамі, гісторыя тэрміналогіі і класіфікацыі нейраэндакрынных пухлін падстраўнікавай залозы складаная[26]. Нейраэндакрынныя пухліны падстраўнікавай залозы часам называюць «ракам астраўковых клетак»[28], хоць цяпер ужо вядома, што яны на самой справе не ўзнікаюць з астраўковых клетак, як лічылася раней[27].
Прыкметы і сімптомы[правіць | правіць зыходнік]

Паколькі рак падстраўнікавай залозы на ранніх стадыях часта не выклікае выразных сімптомаў, хвароба звычайна не дыягнастуецца, пакуль пухліна не распаўсюдзілася па-за межы самой падстраўнікавай залозы[9]. Гэта адна з асноўных прычын высокай смяротнасці ад РПЗ. Выключэннем з’яўляюцца функцыянуючыя нейраэндакрынныя пухліны, дзе празмерная прадукцыя актыўных гармонаў можа выклікаць заўважныя сімптомы, якія залежаць ад тыпу гармона[29].
Захворванне рэдка дыягнастуецца да 40-гадовага ўзросту. Звычайнымі сімптомамі адэнакарцыномы падстраўнікавай залозы, якія ўзнікаюць да дыягназу, з’яўляюцца:
- Боль у верхняй частцы жывата ці спіны, часта распаўсюджваецца ад жывата на спіну. Месца болю можа быць індыкатарам таго, у якой частцы падстраўнікавай залозы знаходзіцца пухліна. Боль можа ўзмацняцца ўначы, прагрэсаваць з часам да вельмі моцнага і няспыннага[23]. Боль можна крыху суцішацца, калі нахіляцца ўперад. У Вялікабрытаніі каля паловы новых выпадкаў РПЗ дыягнастуюцца пасля звароту па хуткую дапамогу з-за болю ці жаўтухі. У прыблізна дзвюх трацін людзей боль у жываце з’яўляецца асноўным сімптомам, 46 % РПЗ суправаджаецца жаўтухай, у 13 % выпадкаў жаўтуха не суправаджаецца болем[7].
- Жаўтуха, пажаўценне вачэй або скуры, якія суправаджаюцца болем альбо без яго, у спалучэнні з пацямнелай мачой. Гэтыя сімптомы могуць сведчыць пра тое, што рак у галоўцы падстраўнікавай залозы перакрывае агульную жоўцевую пратоку, якая праходзіць праз падстраўнікавую залозу[29].
- Невытлумачальная страта вагі — з-за страты апетыту або страты экзакрыннай функцыі, што вядзе да недастатковага стрававання[7].
- Пухліна можа сціскаць суседнія органы, парушаючы стрававальныя працэсы і абцяжарваючы апаражненне страўніка, што можа выклікаць млоснасць і адчуванне запоўненасці. Неперастрававаныя тлушчы прыводзяць да непрыемнага на пах, поўнага тлушчу кала, які цяжка змываецца ў прыбіральні[7]. Таксама часта здараецца зацвердзь (запор)[30].
- Як мінімум 50 % людзей з адэнакарцыномай падстраўнікавай залозы маюць дыябет на момант дыягназу[6]. Даўні дыябет з’яўляецца вядомым фактарам рызыкі развіцця РПЗ, але і сам рак можа быць прычынай дыябету; таму з’яўленне дыябету можа лічыцца ранняй прыкметай РПЗ[31]. У людзей, старэйшых за 50 гадоў, якія захварэлі на цукровы дыябет, рызыка развіцця адэнакарцыномы падстраўнікавай залозы на працягу наступных трох гадоў у восем разоў большая за сярэднюю, але ў далейшым адносная рызыка змяншаецца[7].
- Іншыя распаўсюджаныя праявы хваробы ўключаюць: слабасць і стому; сухасць у роце; праблемы са сном; і адчувальная брухавінавая маса[30].
Іншыя высновы[правіць | правіць зыходнік]
- Сіндром Трусо, пры якім згусткі крыві адвольна ўтвараюцца ў партальных крывяносных сасудах, у глыбокіх венах канцавінаў або ў павярхоўных венах у любым месцы цела, можа быць звязаны з РПЗ і сустракаецца прыблізна ў 10 % выпадкаў[8].
- Ад 10 да 20 % выпадкаў РПЗ суправаджаецца клінічнай дэпрэсіяй, якая можа замінаць аптымальнаму лячэнню. Дэпрэсія часам заўважаецца яшчэ перад дыягназаваннем рака, што дае падставы меркаваць, што яна можа быць біялагічна звязана з РПЗ[8].
Фактары рызыкі[правіць | правіць зыходнік]
Фактары рызыкі развіцця адэнакарцыномы падстраўнікавай залозы ўключаюць:[4][6][7][32]
- Рызыка развіцця РПЗ павялічваецца з узростам. Большасць выпадкаў здараецца пасля 65 гадоў[4], а выпадкі да 40 гадоў — рэдкасць. Хвароба крыху часцей сустракаецца ў мужчын, чым у жанчын[4].
- Паленне цыгарэт — найлепш даказаны фактар рызыкі развіцця РПЗ. Пры доўгатэрміновым паленні рызыка прыкладна падвойваецца і павялічваецца з колькасцю спажываных цыгарэт і працягласцю гісторыі палення. Пасля адмовы ад палення рызыка паволі зніжаецца і пасля прыблізна 20 гадоў вяртаецца да ўзроўню тых, хто не паліць[33].
- Атлусценне: ІМЦ большы за 35 павялічвае адносную рызыка прыблізна ўдвая[7].
- Сямейная гісторыя: 5-10 % выпадкаў РПЗ маюць спадчынны кампанент у людзей з сямейнай гісторыя РПЗ[6][34]. Рызыка значна ўзмацняецца, калі РПЗ меў месца ў найбліжэйшых крэўных сваякоў, але менш значна, калі РПЗ меў месца ва ўзросце да 50 гадоў[9]. Большасць генаў, звязаных з развіццём РПЗ, не былі ідэнтыфікаваны[6][35]. Спадчынны панкрэатыт павялічвае на 30-40 % рызыку развіцця РПЗ на працягу жыцця да ўзросту 70 гадоў[8].
- Узаемасувязь РПЗ устаноўлена з наступнымі іншымі рэдкімі спадчыннымі сіндромамі: сіндром Пейца-Джэгера, абумоўлены мутацыямі гена-супрэсара пухлін STK11 (вельмі рэдкі, але вельмі істотны фактар рызыкі); сіндром дыспластычнага невуса (FAMMM-PC) з-за мутацый у гене-супрэсары пухлін CDKN2A; аўтасомная рэцэсіўная атаксія тэлеангіэктазія і аўтасомная дамінантная мутацыя гена BRCA2 і гена PALB2; спадчынны непаліпозны рак тоўстай кішкі (сіндром Лінча); і сямейны адэноматозны паліпоз. Нейраэндакрынныя карцыномы асацыююцца з множнымі эндакрыннымі неаплазмамі тыпу 1 (MEN1) і сіндромам фон Гіппеля — Ліндаў[6][8][9]
- Хранічны панкрэатыт стварае амаль патройную рызыку і, як і пры дыябеце, новы панкрэатыт можа быць сімптомам пухліны[8]. Рызыка развіцця РПЗ у асоб з сямейным панкрэатытам асабліва высокі[8][35].
- Цукровы дыябет з’яўляецца фактарам рызыкі развіцця РПЗ і, як адзначана ў раздзеле Прыкметы і сімптомы, новавыяўлены дыябет можа быць ранняй прыкметай захворвання. У людзей, якія пражылі з дыягназам цукровага дыябету 2-га тыпу больш за дзесяць гадоў, рызыка развіцця РПЗ павялічваецца на 50 % у параўнанні з асобамі без дыябету[8].
- Няма выразных доказаў, што пэўныя віды ежы (у адрозненне ад атлусцення) павялічваюць рызыку развіцця РПЗ[6][36]. Ёсць некаторыя падставы меркаваць, што апрацаванае мяса, чырвонае мяса і мяса, прыгатаванае пры вельмі высокіх тэмпературах (смажанне, грыль, шашлыкі) асацыюецца з нязначным павелічэннем рызыкі[36][37].
Алкаголь[правіць | правіць зыходнік]
Празмернае ўжыванне алкаголю з’яўляецца асноўнай прычынай хранічнага панкрэатыту, што, у сваю чаргу, стварае схільнасць да РПЗ. Вялікая колькасць праведзеных даследаванняў, аднак, не змаглі адназначна даказаць, што спажыванне алкаголю з’яўляецца непасрэдным фактарам рызыкі развіцця РПЗ. У цэлым, асацыяцыя з ужываннем алкаголя стабільна слабая, а большасць даследаванняў не выявілі ніякай узаемасувязі, пры гэтым паленне з’яўляецца значным змешвальным фактарам. Больш пэўныя доказы сувязі РПЗ з алкаголем ёсць у дачыненні да ўжывання яго ў вялікіх колькасцях — прынамсі, шэсць напояў у дзень.[8][38].
Паталагічная фізіялогія[правіць | правіць зыходнік]
Перадракавы стан[правіць | правіць зыходнік]
Прынята лічыць, што экзакрынныя карцыномы ўзнікаюць з некалькіх відаў перадракавых паражэнняў у падстраўнікавай залозе. Гэтыя паражэнні не заўсёды прагрэсуюць у рак. Усё большая іх колькасць выяўляецца як пабочны прадукт больш частага выкарыстання КТ дзеля іншых мэтаў, і не ўсе яны патрабуюць лячэння[8]. Акрамя сэрозных цыстадэном падстраўнікавай залозы (SCNs), якія амаль заўсёды дабраякасныя, распазнаюцца чатыры віды перадракавых паражэнняў:
- Унутраэпітэліяльныя неаплазіі (IENs) падстраўнікавай залозы з’яўляюцца мікраскапічнымі парушэннямі ў падстраўнікавай залозе і часта сустракаюцца пры ўскрыцці цела людзей, якія не мелі дыягнаставанага рака. Гэтыя паражэнні могуць прагрэсаваць ад нізкай да высокай стадыі, а затым і да пухліны. У больш за 90 % выпадкаў на ўсіх стадыях выялены дэфектыўны ген KRAS, а ў выпадках 2-й і 3-й стадый з узрастаючай частатой сустракаюцца дэфекты яшчэ трох генаў: CDKN2A (p16), p53 і SMAD4.[6]
- Унутрапратокавыя папілярныя муцынозныя неаплазіі (IPMNs) — макраскапічныя паражэнні, якія сустракаюцца прыблізна ў 2 % дарослых людзей. Гэты адсотак павялічваецца да прыблізна 10 % ва ўзросце 70 гадоў. Гэтыя паражэнні маюць каля 25 % рызыкі паратварыцца ў інвазіўный рак. Яны могуць мець мутацыі генаў KRAS (у прыблізна 40-65 % выпадкаў) і ў альфа-субадзінцы GNAS Gs і RNF43, і ўплываць на сігнальны шлях Wnt[6]. Нават калі гэтыя неаплазіі выдаляюцца хірургічным чынам, захоўваецца значна павышаная рызыка развіцця РПЗ ў далейшым[8].
- Муцынозныя кістозныя неаплазіі (MCNs) падстраўнікавай залозы у асноўным сустракаюцца ў жанчын і могуць заставацца дабраякаснымі ці пераўтварацца ў рак[39]. Калі гэтыя паражэнні становяцца вялікімі, выклікаюць сімптомы або набываюць падазроныя прыкметы, іх звычайна можна паспяхова выдаліць хірургічным чынам[8].
- Унутрапратокавыя тубулапапілярныя неаплазіі былі вызначаны СААЗ ў асобны від у 2010 годзе. Яны складаюць ад 1 да 3 % усіх неаплазій падстраўнікавай залозы. Сярэдні ўзрост на момант пастаноўкі дыягназа складае 61 год, а вядомы дыяпазон — ад 35 да 78 гадоў. Каля 50 % гэтых паражэнняў становяцца інвазіўными. Дыягностыка асноўваецца на гісталогіі, бо гэтыя паражэнні вельмі цяжка адрозніць ад іншых паражэнняў паводле клінічных і рэнтгеналагічных прыкметаў[40].
Інвазіўны рак[правіць | правіць зыходнік]
Генетычныя з'явы пры пратокавай адэнакарцыноме добра апісаныя, і зроблена поўнае секвенаванне экзома самых распаўсюджаных відаў пухлін. Вядома, што чатыры гены мутуюць у большасці выпадкаў адэнакарцыном: KRAS (у 95 % выпадкаў), CDKN2A (таксама 95 %), TP53 (75 %) і SMAD4 (55 %). У апошнім выпадку прагноз развіцця хваробы асабліва кепскі[8]. Мутацыі і дэлецыі SWI/SNF сустракаюцца прыблізна ў 10–15 % адэнакарцыном[6]. Генетычныя змены ў шэрагу іншых тыпаў РПЗ і перадракавых паражэнняў таксама даследаваны[8]. Транскрыптомны аналіз і секвенаванне мРНК найбольш распаўсюджаных формаў РПЗ выявілі, што 75 % генаў чалавека экспрэсуюцца ў пухлінах, а прыблізна 200 генаў больш выразна экспрэсуюцца ў РПЗ у параўнанні з іншымі тыпамі пухлін[41][42].
Нейраэндакрынныя карцыномы[правіць | правіць зыходнік]
Гены, з якімі часта адбываюцца мутацыі пры нейраэндакрынных карцыномах, адрозніваюцца ад генаў пры экзакрынным РПЗ[43]. Напрыклад, мутацый KRAS звычайна не назіраецца. Замест гэтага спадчынныя мутацыі гена MEN1 прыводзяць да сіндрома MEN1, пры якім першасныя пухліны ўзнікаюць у дзвюх і больш эндакрынных залозах. У прыблізна 40–70 % людзей, народжаных з мутацыяй MEN1, у выніку развіваюцца нейраэндакрынныя карцыномы[44]. Іншыя гены, з якімі часта адбываюцца мутацыі, уключаюць DAXX, mTOR і ATRX[27].
Дыягностыка[правіць | правіць зыходнік]
Сімптомы аденокарцыномы падстраўнікавай залозы звычайна не праяўляюцца на ранніх стадыях захворвання, і самі па сабе яны не з'яўляюцца ўнікальнымі для гэтай хваробы[7][8][45]. Сімптомы адрозніваюцца ў залежнасці ад месцазнаходжання рака ў падстраўнікавай залозе, у якой звычайна выдзяляюць (злева направа на большасці дыяграм) тоўстую галоўку, шыю і звужанае цела, якое заканчваецца ў хвасце.
Незалежна ад месцазнаходжання пухліны, найбольш распаўсюджаным сімптомам з'яўляецца невытлумачальная страта вагі, якая можа быць вялікай значнай. Ад 35 % да 47 % людзей з дыягназам хваробы жаляцца на млоснасць, ваніты або пачуццё слабасці. Пухліны ў галоўцы падстраўнікавай залозы звычайна таксама выклікаюць жаўтуху, боль, страту апетыту, цёмную мачу і светлы кал. Пухліны ў целе і хвасце звычайна таксама выклікаюць боль.[45]
Прызнакамі РПЗ могуць быць атыповы дыябет 2-га тыпу, які цяжка кантраляваць; нядаўняе і невытлумачальнае запалення крывяносных сасудаў, выкліканае згусткамі крыві (тромбафлебіт) - т.зв. сімптом злаякаснасці Трусо (не блытаць з сімптомам латэнтнай тэтаніі Трусо); альбо папярэдняе абвастрэнне панкрэатыту[45]. Лекар можа западозрыць РПЗ, калі ўзнікненне дыябету ў чалавека старэйшага за 50 гадоў, суправаджаецца тыповымі сімптомамі: невытлумачальнай стратай вагі, пастаяннымі болямі ў жываце і спіне, нястраўнасцю, ванітамі або тлушчам у кале[7]. Жаўтуха, якая суправаджаецца бязбольна набрыняным жаўцяком (т.зв. сімптом Курвуазье), таксама можа даць нагоду для падазрэнняў і дапамагчы адрозніць РПЗ ад камянёў у жаўцяку[46].
Такія метады медыцынскіай візуалізацыі, як камп'ютарная тамаграфія (КТ) і эндасанаграфія, выкарыстоўваюцца як для пацверджання дыягназу, так і для прыняцця рашэння аб магчымасці выдалення пухліны хірургічным шляхам - аб ейнай "рэзектабельнасці"[7]. На кантрасным КТ, РПЗ звычайна паказвае паступовае павелічэнне паглынання радыёкантрасту, а не хуткае вымыванне, як пры звычайнай падстраўнікавай залозе, альбо запаволенае вымыванне, як пры хранічным панкрэатыце[47]. Таксама могуць выкарыстоўвацца магнітна-рэзанансная тамаграфія (МРТ) і пазітронна-эмісійная тамаграфія (ПЭТ)[6], а ў некаторых выпадках магнітна-рэзанансная халангіяпанкрэатаграфя можа быць карыснай[45]. Ультрагукавое абследаванне брухавінавай паражніны менш адчувальнае і можа прапусціць невялікія пухліны, але яно можа выявіць рак, які распаўсюдзіўся ў печань, і назапашванне вадкасці ў брухавінавай паражніне - асцыт[7]. Яно можа быць выкарыстана для хуткага і недарагога першаснага абследавання да іншых метадаў[48].
Тонкаіголкавая аспірацыйная пункцыйная біяпсія (ТАПБ), часта - з дапамогай эндасанаграфіі, выкарыстоўваецца там, дзе існуе няпэўнасць у дыягназе. Гісталагічная дыягностыка, аднак, неабавязковая для прыняцця рашэння аб выдаленні пухліны хірургічным шляхам[7].
Функцыянальныя тэсты печані могуць паказаць спалучэнне вынікаў, якія сведчаць аб абструкцыі жоўцевай пратокі: падвышаны ўзровень кан'югаванага білірубіну, гама-глутамілтрансферазу і лужнай фасфатазы. Пухлінны маркер СА19-9 (вугляводны антыген 19,9) часта падвышаецца пры РПЗ. Яму, аднак, бракуе адчувальнасці і спецыфічнасці, не ў апошнюю чаргу таму, што ў 5 % людзей адсутнічае антыген Люіса (а) і яны не могуць выпрацоўваць CA19-9. Маркер мае адчувальнасць 80 % і спецыфічнасць - 73 % для выяўленні адэнакарцыномы падстраўнікавай залозы. Ян выкарыстоўваецца для назірання ўжо вядомых выпадкаў, а не для дыягностыкі[6][7].
Гісталогія[правіць | правіць зыходнік]
Найбольш распаўсюджанай форме РПЗ - адэнакарцыноме - уласцівыя ўмераныя і слаба дыферэнцыраваныя залозныя структуры пры мікраскопным даследванні. Звычайна назіраецца значная дэсмаплазія або з'яўленне шчыльнай фібрознай стромы або структурнай тканкі, якая складаецца з цэлага шэрагу тыпаў клетак (у тым ліку - міяфібрабласты, макрафагі, лімфацыты і мастацыты) і дэпанаваных матэрыялаў (напрыклад, калаген 1-га тыпу і гіялуронавая кіслата). Гэта стварае пухліннае мікраасяроддзе, беднае на крывяносныя сасуды (гіпаваскулярнасць) і кіслароду (гіпаксія пухліны)[6]. Лічыцца, што гэта замінае прэпаратам хіміятэрапіі дасягнуць пухліны і з'яўляецца адным з фактараў, якія робяць лячэнне РПЗ асабліва складаным[6][8].
| Тып раку | Адносная частата захворвання[3] | Мікраграфія[3] | Імунагістахімічныя маркеры | Імунагістахімічныя маркеры[3] | Генетычныя змены[3] |
|---|---|---|---|---|---|
| Пратокавая адэнакарцынома | 90 % | Залозы і дэсмаплазія | 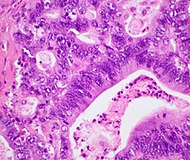 |
|
|
| ацынарнаклеткавая карцынома падстраўнікавай залозы | Ад 1 % да 2 % | Грануляваны выгляд | 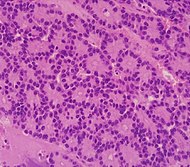
|
|
|
| Адэнасквамозная карцынома | Ад 1 % да 4 %[49] | Спалучэнне залозападобных клетак і плоскаклеткавых эпітэліяльных клетак |  |
Пазітыўныя на:
Негатыўныя на:
|
|
| Нейраэндакрынныя пухліны падстраўнікавай залозы | 5 % | Множныя гнёзды пухлінавых клетак | 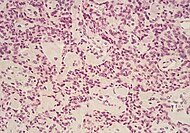 |
|
|
| Перадракавыя паражэнні для параўнання: | |||||
| Унутрапратокавая папілярная муцынозная неаплазія (IPMN) | 3 % | Муцынозныя эпітэліяльныя клеткі[50]. Рост у пратоках падстраўнікавай залозы[51]. | 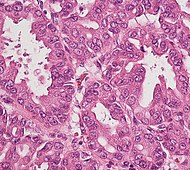
|
|
|
Групаванне па стадыях[правіць | правіць зыходнік]
Экзакрынныя карцыномы[правіць | правіць зыходнік]
Стадыя РПЗ звычайна вызначаецца пасля КТ[45]. Найбольш распаўсюджанай сістэмай вызначэння стадыі РПЗ з'яўляецца сістэма, распрацаваная Амерыканскім сумесным камітэтам па раку (AJCC) сумесна з Саюзам міжнароднага кантролю над ракам (UICC). Сістэма AJCC-UICC вызначае чатыры асноўныя стадыі: ад ранняй да запушчанай хваробы, згодна з TNM класіфікацыяй: памер першаснай пухліны (Tumor size), распаўсюджванне ў рэгіянальныя лімфатычныя вузлы (spread to lymph Nodes) і наяўнасць аддаленых метастазаў (Metastasis)[52].
Каб дапамагчы з рашэннем аб лячэнні, новаўтварэнні падзяляюцца на тры шырокія катэгорыі - у залежнасці ад таго, ці хірургічнае выдаленне пухліны ўяўляецца магчымым. Пухліны ацэньваюцца як "рэзектабельныя", "памежна-рэзектабельныя", альбо "неаперабельныя"[53]. Калі захворванне яшчэ знаходзіцца на ранняй стадыі (I і II стадыі ў класіфікацыі AJCC-UICC) і не пашырылася на буйныя крывяносныя сасуды ці аддаленыя органы, такія як пячонка ці лёгкія, можа праводзіцца хірургічная рэзекцыя пухліны, калі пацыент згодны і фізічна моцны для гэтай складанай аперацыі[7]. Сістэма ацэнкі па стадыях AJCC-UICC дазваляе адрозніваць сярод пухлін III стадыі тыя, што з'яўляюцца "памежна-рэзектабельнымі" - дзе хірургічнае ўмяшанне тэхнічна магчыма, бо чэраўны ствол і верхняя брыжаечная артэрыя не закрануты, - ад "неаперабельных" з-за большага лакальнага развіцця захворвання. З пункту гледжання больш падрабязнай класіфікацыі TNM, гэтыя дзве групы адпавядаюць адпаведна Т3 і Т4[8].

Калі адэнакарцыномы пашыраюцца на важныя крывяныя і лімфатычныя вузлы і нервы, якія праходзяць блізка да падстраўнікавай залозы, гэта значна ўскладняе хірургічнае выдаленне РПЗ. Тыповымі ўчасткамі метастатычнага распаўсюджвання РПЗ - у 50% і больш запушчаных захворванняў, калі яны пераходзяць у IV стадыю, - з'яўляюцца печань, брухавінавая паражніна і лёгкія[54]. Яны рэдка распаўсюджваецца ў косткі ці мозг.[13]
Нейраэндакрынныя карцыномы[правіць | правіць зыходнік]
У класіфікацыі пухлін стрававальнай сістэмы СААЗ 2010 г. нейраэндакрынныя пухліны падстраўнікавай залозы класіфікуюцца паводле трох катэгорый у залежнасці ад ступені іх клеткавай дыферэнцыяцыі (ад "NET G1" да слаба дыферэнцыраванай "NET G3")[20]. Нацыянальная комлексная анкалагічная сетка ЗША рэкамендуе выкарыстоўваць тую ж самую сістэму вызначэння стадый AJCC-UICC, што і для адэнакарцыномы падстраўнікавай залозы[55]. Пры выкарыстанні гэтай схемы паэтапныя вызначэнні для нейраэндакрынных карцыном адрозніваюцца ад вызнчэнняў для экзакрынных пухнін[56]. Іншую сістэму TNM для нейраэндакрынных карцыном прапанавала Еўрапейскае таварыства нейраэндакрынных пухлін[20].
Прафілактыка і скрынінг[правіць | правіць зыходнік]
Разам з адмовай ад палення, Амерыканскае анкалагічнае таварыства рэкамендуе падтрымліваць здаровую вагу і спажываць большую колькасць садавіны, гародніны і цэльназерневых прадуктаў, і змяншаць спажыванне чырвонага і апрацаванага мяса (аднак прамых паслядоўных доказаў, што такія змены ў дыеце могуць прадухіліць або зменшыць рызыку РПЗ, няма)[57]. У 2014 г. сістэматычнае даследванне-агляд паказала, што ёсць дастаткова доказаў таму, што спажыванне цытрусавых і куркумы змяншае рызыку РПЗ і, магчыма, ёсць станоўчы эфект ад цэльназерневых прадуктаў, фоліевай кіслаты, селену і нясмажанай рыбы[38].
Па стане на 2019 г. скрынінг вялікіх груп насельніцтва не лічыцца эфектыўным, а можа быць шкодным[58]. Разам з тым, новыя метады і скрынінг строга вызначаных мэтавых груп праходзіць ацэнку[59][60]. Рэгулярнае абследаванне з дапамогай эндаскапічнага УГД і МРТ або КТ рэкамендуецца асобам з падвышанай рызыкай, абумоўленай спадчыннай генетыкай[9][48][60][61].
Лячэнне[правіць | правіць зыходнік]
Экзакрынныя карцыномы[правіць | правіць зыходнік]
Ключавой ацэнкай, якая праводзіцца пасля дыягностыкі, з'яўляецца вызначэнне магчымасці хірургічнага выдалення пухліны (гл. Групаванне па стадыях), паколькі гэта адзіны спосаб вылячэння ад РПЗ. Магчымасць выканання хірургічнай рэзекцыі залежыць ад таго, наколькі рак распаўсюдзіўся. Дакладнае месцазнаходжанне пухліны таксама з'яўляецца важным фактарам. КТ можа паказаць, як яна звязана з асноўнымі крывяноснымі сасудамі, якія праходзяць побач з падстраўніцы. Таксама трэба браць пад увагу агульны стан здароўя чалавека. Сталы ўзрост сам па сабе не з'яўляецца перашкодай для хірургічнага лячэння[8].
Хіміятэрапія і, у меншай ступені, прамянёвая тэрапія, прапануюцца большасці пацыентаў, незалежна ад магчымасці хірургічнага ўмяшання. Пажадана, каб лячэнне РПЗ выконвала міждысцыплінарная група, якая складаецца з спецыялістаў у некалькіх аспектах анкалогіі. Таму лячэнне лепш праводзіць у буйных шпіаталях [6][8].
Хірургічнае лячэнне[правіць | правіць зыходнік]
Хірургічная аперацыя з мэтай лячэння магчыма толькі прыблізна ў адной пятай (20 %) новых выпадкаў РПЗ[7]. Нягледзячы на тое, што КТ дапамагае прыняць рашэнне, на практыцы не заўсёды можна папярэдне вызначыць, ці пухліну атрымаецца выдаліць цалкам (ейная «рэзектабельнасць»), і толькі падчас аперацыі становіцца відавочным, што паспяховае выдаленне пухліны без пашкоджання іншых жыццёва важных тканак немагчыма. Магчымасць хірургічнай рэзекцыі залежыць ад розных фактараў, напрыклад, дакладная ступень мясцовага анатамічнага прылягання да вянозных і артэрыяльных крывяносных сасудаў альбо іх ахоп пухлінай[6], ступень наяўнай хірургічнай экспертызы і вынікі ўважлівай ацэнкі прагназаванага пасляаперацыйнага аднаўлення[62][63]. Узрост пацыента сам па сабе не з’яўляецца прычынай не праводзіць хірургічнае лячэнне, але яго агульны стан павінен адпавядаць патрабаванням цяжкай аперацыі[7].
Адна з асаблівасцей, якая бярэцца пад увагу, — гэта наяўнасць (яна заахвочваецца) або адсутнасць (што з’яўляецца перашкодай) празрыстага пласта тлушчу паміж пухлінай і сасудамі[8]. Традыцыйна робіцца ацэнка блізкасці пухліны да асноўных вянозных і артэрыяльных сасудаў з пункту гледжання «нахілення» (вызначаецца як дакрананне пухлінай не больш чым да паловы акружнасці крывяноснага сасуда без тлушчу паміж імі), «абвалоквання» (калі пухліна ахоплівае большую частку акружнасці сасуда) альбо поўны ахоп сасуда[64]. У некаторых выпадках рэзекцыя можа быць магчымай, нават калі пухліна ахоплівае часткі крывяносных сасудаў[65][66], асабліва калі магчымая папярэдняя неаад'ювантная тэрапія[67][68][69] з выкарыстаннем хіміятэрапіі[63][64][70] і (або) прамянёвай тэрапіі.[64]
Нават калі аперацыя прайшла паспяхова, ракавыя клеткі часта выяўляюцца на ўскрайках выдаленай тканіны, калі патолагаанатам даследуе іх мікраскапічна. Мікраскапічнае даследванне робіцца заўсёды, і пацыенту аддаюцца яго вынікі ў выглядзе заключэння і «шкельцаў». Наяўнасць пухлінавых клетак сведчыць пра тое, што рак не быў цалкам выдалены.[6] Акрамя таго, стволавыя клеткі рака звычайна не выяўляюцца мікраскапічна. Яны могуць працягваць развівацца і распаўсюджвацца.[71][72] Можа праводзіцца даследчая лапараскапія — невялікая хірургічная працэдура з дапамогай камеры, — каб атрымаць больш дакладнае ўяўленне пра вынік галоўнай аперацыі.[73]
Для лячэння выпадкаў, калі пухліна пашкодзіла галоўку падстраўнікавай залозы, звычайна ўжываецца працэдура Уіпла. Гэта цяжкая хірургічная аперацыя, якая ўключае выдаленне разам галоўкі падстраўнікавай залозы і выгіна дванаццаціперснай кішкі (панкрэатадуадэнактамія або панкрэатадуадэнтальная рэзекцыя), стварэнне абводнага шляху для ежы са страўніка ў тонкую кішку (гастра-ейнастамія) і прымацаванне пятлі тонкай кішкі да пузырнай пратокі для адводу жоўці (халецыста-ейнастамія). Працэдуру Уіпла можна праводзіць толькі ў тым выпадку, калі чалавек здольны вытрымаць сур’ёзную хірургічную аперацыю і калі пухліна лакалізавана — не распаўсюдзілася ў мясцовыя структуры і не метастазавала. Па гэтай прычыне працэдура робіцца ў нязначнай колькасці выпадкаў РПЗ. Рак хваста падстраўнікавай залозы можна рэзекаваць пры дапамозе працэдуры, вядомай як дыстальная рэзекцыя падстраўнікавай залозы, якая часта таксама ўключае выдаленне селязёнкі.[6][8] У нашы дні гэта часта можна зрабіць з выкарыстаннем малаінвазіўнай хірургіі.[6][8]
Нягледзячы на тое, што лячэбная хірургія больш не суправаджаецца вельмі высокім ўзроўнем смяротнасці, што мела месца да 1980-х гадоў, значная прапорцыя пацыентаў (каля 30-45 %) мусіць атрымліваць лячэнне ад пасляаперацыйных хваробаў, якія не выкліканы самім ракам. Найбольш распаўсюджаным ускладненнем хірургічнага ўмяшання з’яўляецца цяжкасць апаражнення страўніка.[8] Пэўныя абмежаваныя хірургічныя працэдуры могуць ужывацца для аблягчэння сімптомаў (гл. Паліятыўная дапамога), напрыклад, калі рак пранікае ў або сціскае дванаццаціперсную кішку ці тоўстую кішку. У такіх выпадках шунтаванне можа пераадолець абструкцыю і палепшыць якасць жыцця, хоць і не прывядзе да вылячэння.[7]
Хіміятэрапія[правіць | правіць зыходнік]
Пасля перыяду аднаўлення ад аднаго да двух месяцаў пасля аперацыі прапануеца ад'ювантная хіміятэрапія кальцыя фалінатам, гемцытабінам, капецытабінам або 5-фторурацылам,[74] калі чалавек знаходзіцца ў дастаткова добрым стане.[9][48] У людзей, якім лячэбнае (радыкальнае) хірургічнае лячэнне па пасуе, хіміятэрапія можа выкарыстоўвацца для падаўжэння жыцця або паляпшэння яго якасці.[8] У выпадках, якія лічацца "пагранічнымі", прад хірургічным умяшаннемм можа выкарыстоўвацца неаад'ювантная хіміятэрапія або хіміяпрамянёвая тэрапію (гл. Дыягностыка) з мэтай змяншэння пухліны да ўзроўню, калі аперацыя можа быць карыснай. У іншых выпадках неаад'ювантная тэрапія застаецца спрэчным пытаннем, бо адкладае аперацыю на пазнейшы тэрмін.[8][9][75]
У Беларусі стандартнымі формамі хіміятэрапіі пры РПЗ з'яўляюцца кальцыя фалінат, гемцытабін, капецытабін і схемы GEMCAR і FOLFIRINOX.[74]
У ЗША гемцытабін быў зацверджаны для ўжытку Упраўленнем па санітарным наглядзе за якасцю харчовых прадуктаў і лекаў (FDA) у 1997 годзе пасля таго, як клінічнае даследаванне паказала паляпшэнне якасці жыцця і пяцітыднёвае павялічэнне сярэдняй працягласці жыцця ў пацыентаў на позніх стадыях РПЗ.[76] Хіміятэрапія з выкарыстаннем аднаго гемцытабіну была стандартам цягам прыблізна дзясяцігоддзя, бо шэраг даследванняў, якія выпрабоўвалі яго ў спалучэнні з іншымі прэпаратамі, не прадэманстравалі істотна лепшых вынікаў. Аднак было ўстаноўлена, што камбінацыя гемцытабіну з эрлацінібам нязначна павялічвае выжывальнасць. У выніку FDA дазволіў выкарыстоўваць пры РПЗ эрлацініб у 2005 г.[77]
Схема хіміятэрапіі FOLFIRINOX, якая складаецца з чатырох прэпаратаў, была прызнана больш эфектыўнай, чым гемцытабін, але яна выклікае значныя пабочныя эфекты, таму падыходзіць толькі пацыентам з добрай вынослівасцю. Гэта тычыцца і наб-паклітаксэла, які FDA дазволіў для выкарыстання ў камбінацыі з гемцытабінам пры РПЗ у 2013 г.[78] Пад канец 2013 г. FOLFIRINOX і камбінацыя наб-паклітаксэла з гемцытабінам лічыліся добрым выбарам для тых, хто здольны пераносіць пабочныя эфекты, а гемцытабін заставаўся найбольш эфектыўным варыянтам для тых, хто не. Шматлікія даследванні варыянтаў хіміятэрапіі ў апошнія гады павячылі працягласць жыцця з РПЗ толькі на некалькі месяцаў.[76]
Хіміяпрамянёвая тэрапія[правіць | правіць зыходнік]
У Беларусі ўжываецца ад'ювантная (дапаможная) хіміяпрамянёвая тэрапія: камбінацыя 5-фторурацыла і дыстанцыйнай прамянёвай тэрапіі. У выпадку хірургічнага лячэння ад'ювантная хіміяпрамянёвая тэрапія праводзіцца праз 6-8 тыдняў пасля аперацыі.[74]
Роля прамянёвай тэрапіі як ад'ювантнага (дапаможнага) лячэння пасля патэнцыяльна вылячальнай хірургіі была прадметам дыскусій з 1980-х гадоў.[8] Еўрапейскае таварыства медыцынскай анкалогіі рэкамендуе выкарыстоўваць ад'ювантную прамянёвую тэрапію толькі выпадку клінічных выпрабаванняў [52]. У ЗША больш ахвотна прымяняюць ад'ювантную прамянёвую тэрапію. Прамянёвая тэрапія можа прымяняцца для зменшэння пухліны да рэзектабельнага стану, але яе выкарыстанне пры неаперабельных пухлінах застаецца спрэчным. З 1980-х гадоў шматлікія клінічныя выпрабаванні так і не паказалі адназначна на мэтазгоднасць прымянення прамянёвай тэрапіі ў выпадку РПЗ.[8][9]
Нейраэндакрынныя карцыномы[правіць | правіць зыходнік]
Лячэнне нейраэндакрынныя карцыном, у тым ліку яго менш распаўсюджаных злаякасных тыпаў, можа ўключаць шэраг метадаў.[55][79][80][81] Некаторыя невялікія пухліны дыяметрам менш за 1 см, якія выпадкова ідэнтыфікуюцца падчас, напрыклад, КТ, могуць заставацца пад назіраннем.[55] Рашэнне залежыць ад ацэнкі рызыкі хірургічнага ўмяшання, на якую ўплывае месца пухліны і наяўнасць медыцынскіх ускладненняў.[55] Тып хірургічнага ўмяшання залежыць ад размяшчэння пухліны і ступені распаўсюджвання ў лімфатычныя вузлы. Пухліны, якія цалкам знаходзяцца ў падстраўнікавай залозе (лакалізаваныя пухліны) альбо з абмежаванымі метастазамі, напрыклад у печань, могуць быць выдалены хірургічным шляхам.[20]
Пры лакалізаваных пухлінах хірургічная працэдура можа быць значна меншай, чым апісаныя вышэй віды хірургічнага ўмяшання, якія выкарыстоўваюцца пры лячэнні адэнокарцыномы падстраўнікавай залозы. У выпадку больш прасунутай пухліны хірургічныя працэдуры падобныя на тыя, што і пры экзакрыннай пухліне. Дыяпазон магчымых вынікаў вельмі шырокі: некаторыя тыпы нейраэндакрынных карцыном маюць вельмі высокую ступень выжывання пасля аперацыі, а іншыя маюць дрэнны прагноз. Паколькі нейраэндакрынныя карцыномы сустракаюцца рэдка, лячэнне павінна праводзіцца ў спецыялізаваным цэнтры.[20][27] Трансплантацыя печані можа быць пажаданай у некаторых выпадках метастазаў у печань.[82]
Прамянёвая тэрапія можа выкарыстоўваецца ў некаторых выпадках, калі ўз'яўляецца боль, напрыклад, з-за пашырэння метастазаў ў косткі. Некаторыя нейраэндакрынныя карцыномы паглынаюць пэўныя пептыды альбо гармоны, і гэтыя пухліны могуць рэагаваць на прамянёвую тэрапію радыёактыўна пазначанымі пептыдамі або гармонамі, такімі як іёбенгуан (ёд-131-MIBG).[83][84][85][86] Таксама могуць выкарыстоўвацца радыёчастотная абляцыя (RFA), крыяабляцыя і эмбалізацыя пячоначнай артэрыі.[87][88]
Паліятыўнае лячэнне[правіць | правіць зыходнік]
Паліятыўнае лячэнне - гэта медыцынская дапамога, накіраваная на лячэнне сімптомаў цяжкіх захворванняў, такіх як рак, і паляпшэнне якасці жыцця.[89] Паколькі адэнакарцынома падстраўнікавай залозы звычайна дыягнастуецца пасля таго, як яна перайшла ў запушчаную стадыю, паліятыўная дапамога для аблягчэння сімптомаў часта з'яўляецца адзіным магчымым метадам лячэння.[90]
Паліятыўная дапамога скіраваная не на лячэнне асноўнага рака, а на лячэнні такіх сімптомаў, як боль або млоснасць.[91] Боль можа ўтаймоўвацца лекамі, напрыклад апіоідамі, альбо пры дапамозе такіх працэдурных умяшанняў, як правадніковай анастэзіі на сонечным спляценні (CPB). Гэта працэдура змяняе альбо, у залежнасці ад тэхнікі, якая прымяняецца, разбурае нервы, якія перадаюць боль з жывата. CPB - бяспечны і эфектыўны спосаб паменшыць боль. Ён звычайна зніжае неабходнасць апіоідных болесуцяшальнікаў, якія маюць значныя негатыўныя пабочныя эфекты.[8][92]
Іншыя сімптомы або ўскладненні, якія лечацца з дапамогай паліятыўнай хірургіі, з'яўляюцца блакаванне пухлінай кішачніка або жоўцевых параток. У апошнім выпадку, які сустракаецца больш чым у палове выпадкаў РПЗ, невялікая металічная трубка - стэнт - усталёўваецца з дапамогай эндаскопа дзеля дрэнавання праток [29]. Паліятыўнае лячэнне таксама можа прымяняцца для лячэнні дэпрэсіі, якая з'яўляецца частым наступствам дыягназа РПЗ.[8]
І хірургічнае ўмяшанне, і запушчаныя неаперабельныя пухліны часта прыводзяць да парушэнняў у стрававальнай сістэме з-за экзакрыннай недастатковасці. Іх можна лячыць прыёмам панкрэатыну, які змяшчае ферменты падстраўнікавай залозы. Яго найлепш прымаць разам з ежай.[7] Цяжкасці з апаражненнем страўніка (затрымка апаражнення страўніка) сустракаюцца часта і могуць стаць сур'ёзнай праблемай, якая патрабуе шпіталізацыю. Лячэнне можа мець розныя падыходы, у тым ліку зандаванне страўніка, і прэпараты, напрыклад інгібітары пратоннай помпы (альбо антаганісты Н2), якія таксама зніжаюць выпрацоўку страўнікавай кіслаты.[7]
Вынікі[правіць | правіць зыходнік]
| Паказнік | 2011 | 2016 |
|---|---|---|
| Колькасць выяўленых выпадкаў | 992 | 1083 |
| Дыягназ пастаўлены на I стадыі захворвання (%) | 6,6 | 3,9 |
| Дыягназ пастаўлены на II стадыі захворвання (%) | 27,1 | 20,3 |
| Дыягназ пастаўлены на III стадыі захворвання (%) | 24,7 | 19,9 |
| Дыягназ пастаўлены на IV стадыі захворвання (%) | 41,6 | 55,9 |
| Пражылі менш за год з моманту дыягназавання | 78,2 | 72,2 |
Адэнакарцынома падстраўнікавай залозы і іншыя менш распаўсюджаныя экзакрынныя пухліны маюць вельмі дрэнны прагноз, бо звычайна яны дыягнастуюцца на позняй стадыі, калі рак ужо развіўся лакальна альбо распаўсюдзіўся ў іншыя часткі цела.[6] Вынікі значна лепшыя ў выпадку нейраэндакрынных карцыном: многія з іх дабраякасныя і цалкам без клінічных сімптомаў. Нават тыя выпадкі, якія не паддаюцца лячэнню з дапамогай хірургічнага ўмяшання, у 16% маюць сярэдні ўзровень выжывальнасці пяць гадоў,[53] хоць прагноз значна адрозніваецца ў залежнасці ад тыпу пухліны.[29]
Шматлікія выпрабаванні, якія параўноўвалі розныя рэжымы хіміятэрапіі ў дачыненні да лакальна распаўсюджаных і метастатычных адэнакарцыном падстраўнікавай залозы, што разам складаюць больш за 80% выпадкаў РПЗ, дазволілі павялічыць час выжывання ўсяго на год.[6][76] Агульная пяцігадовая выжывальнасць пры РПЗ у ЗША павялічылася з 2% выпадкаў, дыягнаставаных у 1975–1977 гадах, да 4% выпадкаў, дыягназаваных у 1987–1989 гадах, і да 6% - у 2003–2009 гадах.[93] Менш чым у 20% выпадкаў адэнакарцыномы падстраўнікавай залозы з дыягназам лакалізаванага і невялікага росту (менш за 2 см на стадыі Т1) амерыканскія пацыенты жывуць даўжэй за пяць гадоў.[18]
Блізу 1500 генаў маюць дачыненне да наступстваў адэнакарцыномы падстраўнікавай залозы. Сюды ўваходзяць як неспрыяльныя гены, дзе высокая экспрэсія стасуецца з кепскім вынікам, напрыклад C-Met і MUC-1, так і спрыяльныя гены, дзе высокая экспрэсія стасуецца з лепшай выжывальнасцю, напрыклад фактар транскрыпцыі PELP1.[41][42]
Пашыранасць[правіць | правіць зыходнік]
У Беларусі блізу 1000 выпадкаў РПЗ дыягнастуецца штогод.[94] У 2015 годзе РПЗ усіх відаў стаў прычынай 411 600 смерцяў ва ўсім свеце.[15] Хоць на яго долю прыпадае толькі 2,5% новых выпадкаў, анкалагічных захворванняў, РПЗ прыводзіць да 6% выпадкаў смерці ад раку штогод.[95] Гэта сёмая прычына смерці ад раку ва ўсім свеце.[4] РПЗ з'яўляецца пятай па частаце прычынай смерці ад ранкалагічных захворванняў у Вялікабрытаніі [15] і трэцяй - у ЗША [16].
Большасць выпадкаў РПЗ дыягнастуецца ў развітых краінах.[4] У ЗША хвароба часцей сустракаецца ў мужчын, чым у жанчын,[4][6] але розніца ў паказчыках за апошнія дзясяцігоддзі зменшылася, што можа тлумачыцца большай колькасцю жанчын, якія паляць. ЗША, Цэнтральная і Усходняя Еўропа, а таксама Аргенціна і Уругвай маюць высокі паказчык рызыкі захварэць на РПЗ.[4]
Гісторыя[правіць | правіць зыходнік]
Выяўленне і дыягностыка[правіць | правіць зыходнік]
Найранейшае выяўленне РПЗ прыпісваецца італьянскаму навукоўцу 18 стагоддзя Джавані Батысце Марганьі, бацьку сучаснай анатамічнай паталогіі, які сцвярджаў, што выявіў некалькі выпадкаў рака ў падстраўнікавай залозе. Многія лекары XVIII і XIX стагоддзяў скептычна паставіліся да існавання хваробы з-за падобнага выгляду панкрэатыту. Некаторыя выпадкі былі апублікаваны ў 1820-1830-х гадах, а поўны гістапаталагічны дыягназ быў зроблены амерыканскім лекарам і хірургам Джэйкабам Мендэс да Коста, які таксама сумняваўся ў грунтоўнасці інтэрпрэтацый Марганьі. К 20-му стагоддзю рак галоўкі падстраўнікавай залозы стаў агульнапрынятым дыягназам.[96]
Адносна нейраэндакрынных карцыном, верагоднасць рака астраўковых клетак была першапачаткова выказана ў 1888 г. Першы выпадак гіперінсулінізму з-за пухліны гэтага тыпу быў зарэгістраваны ў 1927 г. Выяўленне нейраэндакрынных карцыном, якія не сакрэтуюць інсулін, звычайна прыпісваецца амерыканскім хірургам Р.М. Золінгеру і Э. Элісану. Іх імёнамі быў названы сіндром Золінгера-Элісана пасля таго, як яны выявілі існаванне гастрынапрадукуючых пухлін падстраўнікавай залозы, апісаных у 1955 г. у справаздачы аб двух выпадках незвычайна цяжкіх пептычных язваў.[96] У 2010 годзе СААЗ рэкамендавала змяніць назву эндакрыннымхпухліна на нейраэндакрынныя.[26]
Хірургічнае лячэнне[правіць | правіць зыходнік]
Першая вядомая частковая панкрэатыкадуадэнэктамія была зроблена італьянскім хірургам Алесандра Кадзівіла ў 1898 г., але пацыент пражыў толькі 18 дзён і памёр ад ускладненняў. Раннія аперацыі былі непаспяховыя збольшага з-за памылковага пераканання, што пацыенты памруць, калі спыніцца плыня падстраўнікавых сокаў і каді будзе выдалена дванаццаціперсная кішка. Пазней таксама памылкова меркавалі, што пратока падстраўнікавай залозы можа быць проста перарвана без сур'ёзных негатыўных наступстваў. У 1907–1908 гадах пасля некалькіх няўдалых аперацый іншых хірургаў французскія лекары правялі эксперыментальныя працэдуры на трупах.[97]
У Брэславе ў 1912 г. нямецкі хірург Вальтэр Каўш упершыню выдаліў разам вялікія часткі дванаццаціперснай кішкі і падстраўнікавай залозы. У 1918 г. падчас аперацый на сабаках было прадэманстравана, што істота выжывае нават пасля поўнага выдалення дванаццаціперснай кішкі, але пра такія вынікі ў хірургіі чалавека не паведамлялася да 1935 г., калі амерыканскі хірург Ален Уіпл апублікаваў вынікі трох аперацый, зробленых у Калумбійскім прэзбітарыянскім шпіталі ў Нью-Ёрку. Дванаццаціперсная кішка была выдалена толькі ў аднаго з пацыентаў, але ён пражыў два гады і памёр ад метастазаў у печані. Першая аперацыя была незапланаванай, бо рак быў выяўлены падчас аперацыі. Поспех працэдуры Уіпла вызначыў кірунак хірургічнага лячэння РПЗ, але аперацыя заставалася цяжкай і небяспечнай многія дзясяцігоддзі. Уіпл апублікаваў некалькі ўдакладненняў сваёй працэдуры, у тым ліку першае поўнае выдаленне дванаццаціперснай кішкі ў 1940 г., але ў суме ён зрабіў толькі 37 аперацый.[97]
Выяўленне ў канцы 1930-х гадоўролі вітаміна К у прадухіленні крывацёку пры жаўтусе і ўдасканаленне практыкі пералівання крыві значна палепшылі шанец пасляаперацыйнага выжывання,[97] аднак яшчэ ў 1970-ха гадах каля 25% пацыентаў не выходзілі з лякарні жывымі пасля выдалення РПЗ.[98] У 1970-я гады група амерыканскіх хірургаў заклікала адмовіцца ад працэдуры з-за ейнай небяспекі. З тых часоў вынікі лячэння ў буйных лякарнях значна палепшыліся, і смяротнасць ад аперацыі цяпер часта складае менш за 4%.[22]
У 2006 г. быў апублікаваны даклад аб серыі з 1000 панкрэатэктамій (поўных панкрэатыкадуадэнэктамій), якія былі праведзены хірургам шпіталя Джонса Хопкінса ў перыяд з 1969 па 2003 г. Хуткасць гэтых аперацый пастаянна ўзрастала: з 8,8 гадзін (медыяльны паказчык) у 1970-х да 5,5 гадзін - у 2000-х, а смяротнасць на працягу 30 дзён альбо да выскі з лякарні склала толькі 1%.[97][98] Іншая серыя з 2050 аперацый у Масачусецкай агульнапрофільнай лякарні ў Бостане (ЗША) у перыяд з 1941 па 2011 гг. паказала аналагічнае паляпшэння вынікаў хірургічнага лячэння.[99]
Кірункі даследванняў[правіць | правіць зыходнік]
Даследаванні ранніх стадый РПЗ уключаюць генетыку пухлін і ранняе выяўленне, лячэнне на розных стадыях рака, хірургічныя стратэгіі і таргетныя метады лячэння, такія як затарможванне фактараў росту, імунная тэрапія і вакцыны.[35][100][101][102][103]
Ключавым пытаннем з'яўляецца час і паслядоўнасць з'яў па меры развіцця хваробы, у прыватнасці, роля дыябету,[31][100] а таксама, як і калі хвароба распаўсюджваецца.[104] Веданне таго, што новы дыябет можа быць ранняй прыкметай РПЗ, можа садзейнічаць своечасовай дыягностыцы і прафілактыцы, калі атрымаецца вынайсці дзейсную стратэгію скрынінга.[31][100][105][106] Даследванне "Еўрапейскі рэестра спадчыннага панкрэатыту і сямейнага РПЗ" (EUROPAC) накіравана на вызначэнне таго, ці рэгулярны скрынінг людзей, якія маюць сямейную гісторыю захворвання, можа быць эфектыўным.[107]
Цяпер праходзіць ацэнку магчымасць ужывання лапараскапіі замест працэдуры Уіпла, асабліва з пункту гледжання часу аднаўлення пацыента пасля аперацыі.[108] Незваротная электрапарацыя - адносна новая методыка абляцыі, якая можа дазволіць пераводзіць стан РПЗ на больш раннюю стадыю і падоўжыць выжывальнасць у людзей з лакальна-распаўсюджаным захворваннем, асабліва пры пухлінах, блізіх да панкрэатычных сасудаў, што дазволіла б пазбегнуць пашкоджання сасудаў.[109][110]
Робяцца намаганні па распрацоўцы новых лекаў, у тым ліку скіраваных на малекулярныя механізмы ўзнікнення рака,[111][112] стваловыя клеткі[72] і распаўсюд клетак.[112][113] Іншы падыход прадугледжвае выкарыстанне імунатэрапіі, напрыклад, анкалітычных вірусаў.[114] Роля галектынаў у механізмах мікраасяроддзя пухліны таксама вывучаецца.[115]
Зноскі
- ↑ а б в г Disease Ontology — 2016. Праверана 15 мая 2019.
- ↑ What is Cancer? Defining Cancer. National Cancer Institute, National Institutes of Health (7 сакавіка 2014). Архівавана з першакрыніцы 25 June 2014. Праверана 5 December 2014.
- ↑ а б в г д Unless otherwise specified in boxes, reference is: Pishvaian MJ, Brody JR (2017). "Therapeutic Implications of Molecular Subtyping for Pancreatic Cancer". Oncology (Williston Park). 31 (3): 159–66, 168. PMID 28299752.
- ↑ а б в г д е ё ж з і к л м н о п р Stewart, B.W. and Wild, C.P. (Eds.). World Cancer Report 2014 [World Health Organization]. — Lyon: International Agency for Research on Cancer, 2014. — Раздзел 5, 7. — ISBN 978-92-832-0443-5.
- ↑ а б в г д Pancreatic Cancer Treatment (PDQ®) Patient Version. National Cancer Institute. National Institutes of Health (17 красавіка 2014). Архівавана з першакрыніцы 5 July 2014. Праверана 8 June 2014.
- ↑ а б в г д е ё ж з і к л м н о п р с т у ф х ц ч ш э ю я аа Ryan, David P.; Hong, Theodore S.; Bardeesy, Nabeel (11 September 2014). "Pancreatic Adenocarcinoma". New England Journal of Medicine. 371 (11): 1039–1049. doi:10.1056/NEJMra1404198. PMID 25207767.
- ↑ а б в г д е ё ж з і к л м н о п р с т у ф х ц Bond-Smith, G.; Banga, N.; Hammond, T. M.; Imber, C. J. (16 May 2012). "Pancreatic adenocarcinoma". BMJ. 344 (may16 1): e2476. doi:10.1136/bmj.e2476. PMID 22592847.
- ↑ а б в г д е ё ж з і к л м н о п р с т у ф х ц ч ш э ю я аа аб ав Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH (September 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. 63 (5): 318–348. doi:10.3322/caac.21190. PMC 3769458. PMID 23856911.
- ↑ а б в г д е ё ж Vincent A, Herman J, Schulick R, Hruban RH, Goggins M (Жнівень 2011). "Pancreatic cancer" (PDF). Lancet. 378 (9791): 607–620. doi:10.1016/S0140-6736(10)62307-0. PMC 3062508. PMID 21620466. Архівавана з арыгінала (PDF) 12 студзеня 2015. Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 12 студзеня 2015. Праверана 11 ліпеня 2020.Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 12 студзеня 2015. Праверана 11 ліпеня 2020.
- ↑ Draft Recommendation Statement: Pancreatic Cancer: Screening – US Preventive Services Task Force. www.uspreventiveservicestaskforce.org. Праверана 11 February 2019.
- ↑ Can pancreatic cancer be prevented?. American Cancer Society (11 чэрвеня 2014). Архівавана з першакрыніцы 13 November 2014. Праверана 13 November 2014.
- ↑ Bardou M, Le Ray I (December 2013). "Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies". Best Practice & Research. Clinical Gastroenterology. 27 (6): 881–892. doi:10.1016/j.bpg.2013.09.006. PMID 24182608.
- ↑ а б "Chapter 15; Pancreas" (PDF). Manual for Staging of Cancer (2nd ed.). American Joint Committee on Cancer. pp. 95–98. Архівавана (PDF) з арыгінала 29 Лістапад 2014. See p. 95 for citation regarding «… lesser degree of involvement of bones and brain and other anatomical sites.»
- ↑ Sperti C, Moletta L, Patanè G (15 October 2014). "Metastatic tumors to the pancreas: The role of surgery". World Journal of Gastrointestinal Oncology. 6 (10): 381–392. doi:10.4251/wjgo.v6.i10.381. PMC 4197429. PMID 25320654.
- ↑ а б GBD 2015 Mortality and Causes of Death, Collaborators. (8 October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
{{cite journal}}:|first1=мае агульную назву (даведка) - ↑ Cancer facts and figures – Why we exist – Pancreatic Cancer Research Fund. www.pcrf.org.uk. Праверана 5 April 2019.
- ↑ Pancreatic Cancer – Cancer Stat Facts (англ.). SEER. Праверана 4 April 2019.
- ↑ а б Pancreatic Cancer Treatment (PDQ®) Health Professional Version. National Cancer Institute. National Institutes of Health (21 лютага 2014). Архівавана з першакрыніцы 22 October 2014. Праверана 24 November 2014. «The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20 % of cases. In cases with localized disease and small cancers (<2 cm) with no lymph node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is still associated with a low actuarial five-year survival rate of 18 % to 24 %.»
- ↑ Harris, RE (2013). "Epidemiology of pancreatic cancer". Epidemiology of Chronic Disease. Jones & Bartlett. pp. 181–190. ISBN 978-0-7637-8047-0. Архівавана з арыгінала 24 чэрвеня 2016.
- ↑ а б в г д Oberg, K.; Knigge, U.; Kwekkeboom, D.; Perren, A.; ESMO Guidelines Working, Group. (20 September 2012). "Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 (suppl 7): vii124–vii130. doi:10.1093/annonc/mds295. PMID 22997445. (Table 5 outlines the proposed TNM staging system for PanNETs.)
- ↑ Handbook of Pancreatic Cancer. New York: Springer. 2009. p. 288. ISBN 978-0-387-77497-8. Архівавана з арыгінала 10 September 2017. Праверана 12 June 2016.
- ↑ а б Govindan R (2011). DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology (9th ed.). Lippincott Williams & Wilkins. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN 978-1-4511-0545-2. Online edition, with updates to 2014
- ↑ а б в Tobias JS, Hochhauser D (2014). Cancer and its Management (7th ed.). p. 297. ISBN 978-1-118-46871-5.
- ↑ Types of Pancreas Tumors. The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine (26 красавіка 2012). Архівавана з першакрыніцы 8 October 2014. Праверана 18 November 2014.
- ↑ Farrell JJ, Fernández-del Castillo C (June 2013). "Pancreatic cystic neoplasms: management and unanswered questions". Gastroenterology. 144 (6): 1303–1315. doi:10.1053/j.gastro.2013.01.073. PMID 23622140.
- ↑ а б в The PanNET denomination is in line with WHO guidelines for the classification of tumors of the digestive system WHO classification of tumours of the digestive system – NLM Catalog – NCBI. Архівавана з першакрыніцы 9 September 2017. Праверана 7 September 2017. published in 2010. Historically, PanNETs have also been referred to by a variety of terms, and are still commonly called «pancreatic endocrine tumors». See: Klimstra, David S.; Modlin, Irvin R.; Coppola, Domenico; Lloyd, Ricardo V.; Suster, Saul (August 2010). "The Pathologic Classification of Neuroendocrine Tumors". Pancreas. 39 (6): 707–712. doi:10.1097/MPA.0b013e3181ec124e. PMID 20664470.
- ↑ а б в г Burns WR, Edil BH (March 2012). "Neuroendocrine pancreatic tumors: guidelines for management and update". Current Treatment Options in Oncology. 13 (1): 24–34. doi:10.1007/s11864-011-0172-2. PMID 22198808.
- ↑ The Medical Subject Headings indexing system refers to «islet cell carcinoma», which is subdivided into gastrinoma, glucagonoma, somatostatinoma and VIPoma. See: 2014 MeSH tree at «Pancreatic Neoplasms [C04.588.322.475]» Архівавана 19 сакавіка 2016 года. 16 October 2014
- ↑ а б в Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas. The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine (26 красавіка 2012). Архівавана з першакрыніцы 5 January 2015. Праверана 5 January 2015.
- ↑ а б Alberts, SR; Goldberg, RM (2009). "Chapter 9: Gastrointestinal tract cancers". In Casciato, DA; Territo, MC (рэд-ры). Manual of clinical oncology. Lippincott Williams & Wilkins. pp. 188–236. ISBN 978-0-7817-6884-9.
- ↑ а б в Pannala R, Basu A, Petersen GM, Chari ST (January 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". The Lancet. Oncology. 10 (1): 88–95. doi:10.1016/S1470-2045(08)70337-1. PMC 2795483. PMID 19111249.
- ↑ Causes of pancreatic cancer. NHS Choices. National Health Service, England (7 кастрычніка 2014). Архівавана з першакрыніцы 6 November 2014. Праверана 5 December 2014.
- ↑ Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji BT, Negri E, Li D, Risch HA, Olson SH, Gallinger S, Miller AB, Bueno-de-Mesquita HB, Talamini R, Polesel J, Ghadirian P, Baghurst PA, Zatonski W, Fontham E, Bamlet WR, Holly EA, Bertuccio P, Gao YT, Hassan M, Yu H, Kurtz RC, Cotterchio M, Su J, Maisonneuve P, Duell EJ, Boffetta P, La Vecchia C (July 2012). "Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4)". Annals of Oncology. 23 (7): 1880–1888. doi:10.1093/annonc/mdr541. PMC 3387822. PMID 22104574.
- ↑ Peters, ML; Tseng, JF; Miksad, RA (31 March 2016). "Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment". Clinical Therapeutics. 38 (7): 1622–1635. doi:10.1016/j.clinthera.2016.03.006. PMID 27041411.
- ↑ а б в Reznik R, Hendifar AE, Tuli R (2014). "Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma". Front Physiol. 5: 87. doi:10.3389/fphys.2014.00087. PMC 3939680. PMID 24624093.
- ↑ а б Cancer Facts and Figures 2014. American Cancer Society. Архівавана з першакрыніцы 18 December 2014. Праверана 5 January 2015., p. 19, «Though evidence is still accumulating, consumption of red or processed meat, or meat cooked at very high temperatures, may slightly increase risk.»
- ↑ Larsson SC, Wolk A (студзеня 2012). "Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies". Br J Cancer. 106 (3): 603–607. doi:10.1038/bjc.2011.585. PMC 3273353. PMID 22240790.
- ↑ а б Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME (January 2014). "Nutrition and pancreatic cancer". Anticancer Research. 34 (1): 9–21. PMID 24403441.
- ↑ Delpu Y, Hanoun N, Lulka H, Sicard F, Selves J, Buscail L, Torrisani J, Cordelier P (2011). "Genetic and epigenetic alterations in pancreatic carcinogenesis". Curr Genomics. 12 (1): 15–24. doi:10.2174/138920211794520132. PMC 3129039. PMID 21886451.
- ↑ Rooney, Sarah L.; Shi, Jiaqi (October 2016). "Intraductal Tubulopapillary Neoplasm of the Pancreas: An Update From a Pathologist's Perspective". Archives of Pathology & Laboratory Medicine. 140 (10): 1068–1073. doi:10.5858/arpa.2016-0207-RA. PMID 27684978.
- ↑ а б The human pathology proteome in pancreatic cancer – The Human Protein Atlas. www.proteinatlas.org. Праверана 28 September 2017.
- ↑ а б Uhlen, Mathias; Zhang, Cheng; Lee, Sunjae; Sjöstedt, Evelina; Fagerberg, Linn; Bidkhori, Gholamreza; Benfeitas, Rui; Arif, Muhammad; Liu, Zhengtao (18 August 2017). "A pathology atlas of the human cancer transcriptome". Science [англійская]. 357 (6352): eaan2507. doi:10.1126/science.aan2507. ISSN 0036-8075. PMID 28818916.
- ↑ Lewis MA, Yao JC (February 2014). "Molecular pathology and genetics of gastrointestinal neuroendocrine tumours". Current Opinion in Endocrinology, Diabetes and Obesity. 21 (1): 22–27. doi:10.1097/MED.0000000000000033. PMID 24310147.
- ↑ Thakker, Rajesh V.; Newey, Paul J.; Walls, Gerard V.; Bilezikian, John; Dralle, Henning; Ebeling, Peter R.; Melmed, Shlomo; Sakurai, Akihiro; Tonelli, Francesco; Brandi, Maria Luisa; Endocrine, Society. (1 September 2012). "Clinical Practice Guidelines for Multiple Endocrine Neoplasia Type 1 (MEN1)". The Journal of Clinical Endocrinology & Metabolism. 97 (9): 2990–3011. doi:10.1210/jc.2012-1230. PMID 22723327.
- ↑ а б в г д De La Cruz MS, Young AP, Ruffin MT (April 2014). "Diagnosis and management of pancreatic cancer". Am Fam Physician. 89 (8): 626–632. PMID 24784121.
- ↑ Fitzgerald, J. Edward F.; White, Matthew J.; Lobo, Dileep N. (4 February 2009). "Courvoisier's Gallbladder: Law or Sign?". World Journal of Surgery. 33 (4): 886–891. doi:10.1007/s00268-008-9908-y. PMID 19190960.
- ↑ Piraka, Cyrus; Scheiman, James M. (September 2011). "New diagnostic imaging modalities for pancreatic disease". Current Opinion in Gastroenterology. 27 (5): 475–480. doi:10.1097/MOG.0b013e328349e30c. PMID 21743318.
- ↑ а б в Seufferlein T, Bachet JB, Van Cutsem E, Rougier P (October 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33–40. doi:10.1093/annonc/mds224. PMID 22997452.
- ↑ Skafida, Evangelia; Grammatoglou, Xanthippi; Glava, Chryssoula; Zissis, Dimitrios; Paschalidis, Nikolaos; Katsamagkou, Eleftheria; Firfiris, Nikolaos; Vasilakaki, Thivi (2010). "Adenosquamous carcinoma of the pancreas: a case report". Cases Journal. 3 (1). doi:10.1186/1757-1626-3-41. ISSN 1757-1626.
- ↑ Diana Agostini-Vulaj. Pancreas - Exocrine tumors / carcinomas - Intraductal papillary mucinous neoplasm (IPMN). Pathology Outlines. Topic Completed: 1 July 2018. Revised: 9 March 2020
- ↑ Adsay, Volkan; Mino-Kenudson, Mari; Furukawa, Toru; Basturk, Olca; Zamboni, Giuseppe; Marchegiani, Giovanni; Bassi, Claudio; Salvia, Roberto; Malleo, Giuseppe; Paiella, Salvatore; Wolfgang, Christopher L.; Matthaei, Hanno; Offerhaus, G. Johan; Adham, Mustapha; Bruno, Marco J.; Reid, Michelle D.; Krasinskas, Alyssa; Klöppel, Günter; Ohike, Nobuyuki; Tajiri, Takuma; Jang, Kee-Taek; Roa, Juan Carlos; Allen, Peter; Castillo, Carlos Fernández-del; Jang, Jin-Young; Klimstra, David S.; Hruban, Ralph H. (2016). "Pathologic Evaluation and Reporting of Intraductal Papillary Mucinous Neoplasms of the Pancreas and Other Tumoral Intraepithelial Neoplasms of Pancreatobiliary Tract". Annals of Surgery. 263 (1): 162–177. doi:10.1097/SLA.0000000000001173. ISSN 0003-4932. PMC 4568174. PMID 25775066.
- ↑ Cascinu, S.; Falconi, M.; Valentini, V.; Jelic, S.; ESMO Guidelines Working, Group. (16 June 2010). "Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 21 (Supplement 5): v55–v58. doi:10.1093/annonc/mdq165. PMID 20555103.
- ↑ а б Staging of pancreatic cancer(недаступная спасылка). American Cancer Society (11 чэрвеня 2014). Архівавана з першакрыніцы 10 жніўня 2020. Праверана 29 September 2014.
- ↑ Zyromski, Nicholas J.; Nakeeb, Attila; Lillemoe, Keith D. (2010). Silberman, Howard; Silberman, Allan W. (рэд-ры). Principles and practice of surgical oncology : multidisciplinary approach to difficult problems (online ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. Chapter 35. ISBN 978-0-7817-6546-6. Архівавана з арыгінала 6 February 2015. Праверана 3 November 2014.
{{cite book}}: Папярэджанні CS1: бот: невядомы статус арыгінальнага URL (link) Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 6 лютага 2015. Праверана 7 жніўня 2020.Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 6 лютага 2015. Праверана 7 жніўня 2020. - ↑ а б в г Neuroendocrine tumors, NCCN Guidelines Version 1.2015. National Comprehensive Cancer Network, Inc. NCCN) (11 лістапада 2014). Праверана 25 December 2014.
- ↑ National Cancer Institute. Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®) Incidence and Mortality Archived copy. Архівавана з першакрыніцы 4 January 2015. Праверана 29 December 2014.
- ↑ Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section. American Cancer Society (20 жніўня 2012). Архівавана з першакрыніцы 4 November 2014. Праверана 4 November 2014.
- ↑ Owens DK, Davidson KW, Krist AH, Barry MJ, Cabana M, Caughey AB, et al. (August 2019). "Screening for Pancreatic Cancer: US Preventive Services Task Force Reaffirmation Recommendation Statement". JAMA. 322 (5): 438–444. doi:10.1001/jama.2019.10232. PMID 31386141.
- ↑ He XY, Yuan YZ (August 2014). "Advances in pancreatic cancer research: moving towards early detection". World Journal of Gastroenterology. 20 (32): 11241–8. doi:10.3748/wjg.v20.i32.11241. PMC 4145762. PMID 25170208.
- ↑ а б Okano K, Suzuki Y (August 2014). "Strategies for early detection of resectable pancreatic cancer". World Journal of Gastroenterology. 20 (32): 11230–40. doi:10.3748/wjg.v20.i32.11230. PMC 4145761. PMID 25170207.
- ↑ Goggins M, Overbeek KA, Brand R, Syngal S, Del Chiaro M, Bartsch DK, et al. (January 2020). "Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium". Gut. 69 (1): 7–17. doi:10.1136/gutjnl-2019-319352. PMC 7295005. PMID 31672839.
- ↑ Gurusamy KS, Kumar S, Davidson BR, Fusai G (February 2014). "Resection versus other treatments for locally advanced pancreatic cancer". The Cochrane Database of Systematic Reviews. 2 (2): CD010244. doi:10.1002/14651858.CD010244.pub2. PMID 24578248.
- ↑ а б Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J (December 2011). "Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis". Annals of Surgery. 254 (6): 882–93. doi:10.1097/SLA.0b013e31823ac299. PMID 22064622. S2CID 42685174.
- ↑ а б в Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015. NCCN Guidelines. National Comprehensive Cancer Network, Inc. (4 снежня 2014). Праверана 26 December 2014.
- ↑ Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, et al. (October 2014). "Improving outcomes in pancreatic cancer: key points in perioperative management". World Journal of Gastroenterology. 20 (39): 14237–45. doi:10.3748/wjg.v20.i39.14237. PMC 4202352. PMID 25339810.
- ↑ Lopez NE, Prendergast C, Lowy AM (August 2014). "Borderline resectable pancreatic cancer: definitions and management". World Journal of Gastroenterology. 20 (31): 10740–51. doi:10.3748/wjg.v20.i31.10740. PMC 4138454. PMID 25152577.
- ↑ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (July 2014). "Neoadjuvant strategies for pancreatic cancer". World Journal of Gastroenterology. 20 (28): 9374–83. doi:10.3748/wjg.v20.i28.9374 (неактыўны 2020-08-23). PMC 4110569. PMID 25071332.
{{cite journal}}: Папярэджанні CS1: неактыўны DOI з жнівень 2020 (link) - ↑ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J (April 2010). "Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages". PLOS Medicine. 7 (4): e1000267. doi:10.1371/journal.pmed.1000267. PMC 2857873. PMID 20422030.
- ↑ Christians KK, Evans DB (June 2015). "Additional support for neoadjuvant therapy in the management of pancreatic cancer". Annals of Surgical Oncology. 22 (6): 1755–8. doi:10.1245/s10434-014-4307-0. PMID 25519932.
- ↑ Tsvetkova EV, Asmis TR (August 2014). "Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?". Current Oncology. 21 (4): e650-7. doi:10.3747/co.21.2006. PMC 4117630. PMID 25089113.
- ↑ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY (February 2015). "Pancreatic cancer stem cells: new insight into a stubborn disease". Cancer Letters. 357 (2): 429–37. doi:10.1016/j.canlet.2014.12.004. PMID 25499079.
- ↑ а б Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, et al. (August 2014). "Cancer stem cells: involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics". World Journal of Gastroenterology. 20 (31): 10790–801. doi:10.3748/wjg.v20.i31.10790. PMC 4138459. PMID 25152582.
- ↑ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (July 2016). "Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer". The Cochrane Database of Systematic Reviews. 7: CD009323. doi:10.1002/14651858.CD009323.pub3. PMC 6458011. PMID 27383694.
- ↑ а б в г Министерство здравоохранения Республики Беларусь. Клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований» (руск.) (PDF) 151-60 (6 ліпеня 2018). Праверана 31.01.2021.
- ↑ Heinemann V, Haas M, Boeck S (October 2013). "Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer". Annals of Oncology. 24 (10): 2484–92. doi:10.1093/annonc/mdt239. PMID 23852311.
- ↑ а б в Thota R, Pauff JM, Berlin JD (January 2014). "Treatment of metastatic pancreatic adenocarcinoma: a review". Oncology. 28 (1): 70–74. PMID 24683721.
- ↑ Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride(недаступная спасылка). National Cancer Institute. National Institutes of Health (3 ліпеня 2013). Архівавана з першакрыніцы 29 лістапада 2014. Праверана 5 December 2014.
- ↑ Borazanci E, Von Hoff DD (September 2014). "Nab-paclitaxel and gemcitabine for the treatment of patients with metastatic pancreatic cancer". Expert Review of Gastroenterology & Hepatology. 8 (7): 739–47. doi:10.1586/17474124.2014.925799. PMID 24882381. S2CID 31633898.
- ↑ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, et al. (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors". Neuroendocrinology. 95 (2): 120–34. doi:10.1159/000335587. PMID 22261872. S2CID 6985904.
- ↑ Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, et al. (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes". Neuroendocrinology. 95 (2): 98–119. doi:10.1159/000335591. PMC 3701449. PMID 22261919.
- ↑ Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, et al. (2012). "ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary". Neuroendocrinology. 95 (2): 157–76. doi:10.1159/000335597. PMID 22262022. S2CID 2097604.
- ↑ Rossi RE, Massironi S, Conte D, Peracchi M (January 2014). "Therapy for metastatic pancreatic neuroendocrine tumors". Annals of Translational Medicine. 2 (1): 8. doi:10.3978/j.issn.2305-5839.2013.03.01. PMC 4200651. PMID 25332984.
- ↑ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C (May 2012). "Radionuclide therapy in neuroendocrine tumours: a systematic review". Clinical Oncology. 24 (4): 294–308. doi:10.1016/j.clon.2011.12.003. PMID 22221516.
- ↑ Vinik AI (November 2014). "Advances in diagnosis and treatment of pancreatic neuroendocrine tumors". Endocrine Practice. 20 (11): 1222–30. doi:10.4158/EP14373.RA. PMID 25297671.
- ↑ Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP (March 2010). "Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors". Seminars in Nuclear Medicine. 40 (2): 78–88. doi:10.1053/j.semnuclmed.2009.10.004. PMID 20113677.
- ↑ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G (August 2014). "Peptide receptor radionuclide therapy for advanced neuroendocrine tumors". Thoracic Surgery Clinics. 24 (3): 333–49. doi:10.1016/j.thorsurg.2014.04.005. hdl:11392/2378236. PMID 25065935.
- ↑ Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E (June 2015). "Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors". Cancer Chemotherapy and Pharmacology. 75 (6): 1099–114. doi:10.1007/s00280-014-2642-2. PMID 25480314. S2CID 39434924.
- ↑ Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, et al. (August 2015). "Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group". Annals of Surgical Oncology. 22 (8): 2685–99. doi:10.1245/s10434-014-4145-0. PMID 25366583. S2CID 8129133.
- ↑ Palliative or Supportive Care. American Cancer Society (26 красавіка 2014). Архівавана з першакрыніцы 21 August 2014. Праверана 20 August 2014.
- ↑ Buanes TA (August 2014). "Pancreatic cancer-improved care achievable". World Journal of Gastroenterology. 20 (30): 10405–18. doi:10.3748/wjg.v20.i30.10405. PMC 4130847. PMID 25132756.
- ↑ If treatment for pancreatic cancer stops working. American Cancer Society (11 чэрвеня 2014). Архівавана з першакрыніцы 22 October 2014. Праверана 20 August 2014.
- ↑ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (March 2011). Arcidiacono PG (рэд.). "Celiac plexus block for pancreatic cancer pain in adults". The Cochrane Database of Systematic Reviews (3): CD007519. doi:10.1002/14651858.CD007519.pub2. PMC 6464722. PMID 21412903.
- ↑ Cancer Facts and Figures 2014. American Cancer Society. Архівавана з першакрыніцы 18 December 2014. Праверана 5 January 2015., Table, p. 18, rates adjusted for normal life expectancy
- ↑ Министерство здравоохранения Республики Беларусь. Клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований» (PDF) 151 (6 ліпеня 2018). Праверана 30 студзеня 2021.
- ↑ Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ (2007). "Cancer statistics, 2007". Ca. 57 (1): 43–66. doi:10.3322/canjclin.57.1.43. PMID 17237035. S2CID 22305510.
- ↑ а б Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR (November 1983). "History of the pancreas". American Journal of Surgery. 146 (5): 539–50. doi:10.1016/0002-9610(83)90286-6. PMID 6356946.
- ↑ а б в г Are C, Dhir M, Ravipati L (June 2011). "History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers". HPB. 13 (6): 377–84. doi:10.1111/j.1477-2574.2011.00305.x. PMC 3103093. PMID 21609369.
- ↑ а б Cameron JL, Riall TS, Coleman J, Belcher KA (July 2006). "One thousand consecutive pancreaticoduodenectomies". Annals of Surgery. 244 (1): 10–5. doi:10.1097/01.sla.0000217673.04165.ea. PMC 1570590. PMID 16794383.
- ↑ Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, et al. (September 2012). "Evolution of the Whipple procedure at the Massachusetts General Hospital". Surgery. 152 (3 Suppl 1): S56-63. doi:10.1016/j.surg.2012.05.022. PMC 3806095. PMID 22770961.
- ↑ а б в What's new in pancreatic cancer research and treatment?. American Cancer Society (26 красавіка 2019). Праверана 2 May 2019.
- ↑ Pancreatic cancer research. Cancer Research UK. Архівавана з першакрыніцы 18 February 2014. Праверана 17 July 2014.
- ↑ Australian Pancreatic Genome Initiative. Garvan Institute. Архівавана з першакрыніцы 26 July 2014. Праверана 17 July 2014.
- ↑ Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, et al. (November 2012). "Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes". Nature. 491 (7424): 399–405. Bibcode:2012Natur.491..399.. doi:10.1038/nature11547. PMC 3530898. PMID 23103869.
- ↑ Graham JS, Jamieson NB, Rulach R, Grimmond SM, Chang DK, Biankin AV (September 2015). "Pancreatic cancer genomics: where can the science take us?". Clinical Genetics. 88 (3): 213–9. doi:10.1111/cge.12536. PMID 25388820. S2CID 26414866.
- ↑ Zhang C, Yang G, Ling Y, Chen G, Zhou T (December 2014). "The early diagnosis of pancreatic cancer and diabetes: what's the relationship?". Journal of Gastrointestinal Oncology. 5 (6): 481–8. doi:10.3978/j.issn.2078-6891.2014.055. PMC 4226830. PMID 25436129.
- ↑ Bruenderman EH, Martin RC (March 2015). "High-risk population in sporadic pancreatic adenocarcinoma: guidelines for screening". The Journal of Surgical Research. 194 (1): 212–9. doi:10.1016/j.jss.2014.06.046. PMC 4559279. PMID 25479908.
- ↑ About EUROPAC. European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. Архівавана з першакрыніцы 26 July 2014. Праверана 17 July 2014.
- ↑ Subar D, Gobardhan PD, Gayet B (February 2014). "Laparoscopic pancreatic surgery: An overview of the literature and experiences of a single center". Best Practice & Research. Clinical Gastroenterology. 28 (1): 123–32. doi:10.1016/j.bpg.2013.11.011. PMID 24485260.
- ↑ Weiss MJ, Wolfgang CL (2013). "Irreversible electroporation: a novel pancreatic cancer therapy". Current Problems in Cancer. 37 (5): 262–5. doi:10.1016/j.currproblcancer.2013.10.002. PMID 24331180.
- ↑ Moir J, White SA, French JJ, Littler P, Manas DM (December 2014). "Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer". European Journal of Surgical Oncology. 40 (12): 1598–604. doi:10.1016/j.ejso.2014.08.480. PMID 25307210.
- ↑ Kleger A, Perkhofer L, Seufferlein T (July 2014). "Smarter drugs emerging in pancreatic cancer therapy". Annals of Oncology. 25 (7): 1260–1270. doi:10.1093/annonc/mdu013. PMID 24631947.
- ↑ а б Tang SC, Chen YC (Жнівень 2014). "Novel therapeutic targets for pancreatic cancer". World Journal of Gastroenterology. 20 (31): 10825–44. doi:10.3748/wjg.v20.i31.10825. PMC 4138462. PMID 25152585.
- ↑ Rossi ML, Rehman AA, Gondi CS (August 2014). "Therapeutic options for the management of pancreatic cancer". World Journal of Gastroenterology. 20 (32): 11142–59. doi:10.3748/wjg.v20.i32.11142. PMC 4145755. PMID 25170201.
- ↑ Ady JW, Heffner J, Klein E, Fong Y (2014). "Oncolytic viral therapy for pancreatic cancer: current research and future directions". Oncolytic Virotherapy. 3: 35–46. doi:10.2147/OV.S53858. PMC 4918362. PMID 27512661.
- ↑ Ren B, Cui M, Yang G, Wang H, Feng M, You L, Zhao Y (July 2018). "Tumor microenvironment participates in metastasis of pancreatic cancer". Molecular Cancer. 17 (1): 108. doi:10.1186/s12943-018-0858-1. PMC 6065152. PMID 30060755.
