Дэзоксірыбануклеінавая кіслата

Дэзоксірыбануклеі́навая кіслата́ (ДНК) — адзін з двух тыпаў нуклеінавых кіслот, якія забяспечваюць захоўванне, перадачу з пакалення ў пакаленне і рэалізацыю генетычнай праграмы развіцця і функцыянавання жывых арганізмаў. Асноўная роля ДНК у клетках — доўгатэрміновае захоўванне інфармацыі аб структуры РНК і бялкоў.
У клетках эўкарыёт (жывёл, раслін і грыбоў) ДНК знаходзіцца ў ядры клеткі ў складзе храмасом, а таксама ў некаторых клетачных арганоідах (мітахондрыях і пластыдах). У клетках пракарыятычных арганізмаў (бактэрый і архей) кальцавая ці лінейная малекула ДНК, так званы нуклеатыд, прымацавана знутры да клетачнай мембраны. У іх і ў ніжэйшых эўкарыётаў (напрыклад, дражджэй) сустракаюцца таксама невялікія аўтаномныя, пераважна кальцавыя малекулы ДНК, якія называюцца плазмідамі. Акрамя таго, адна- ці двухланцужковыя малекулы ДНК могуць утвараць геном ДНК-змяшчальных вірусаў.
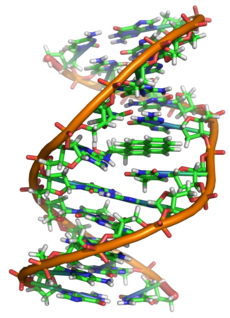
З погляду хіміі, ДНК — гэта доўгая палімерная малекула, складзеная шляхам паўтарэння блокаў — нуклеатыдаў. Кожны нуклеатыд складаецца з азоцістай асновы, цукру (дэзоксірыбозы) і фасфатнай групы. Сувязі паміж нуклеатыдамі ў ланцугу ўтвараюцца за кошт дэзоксірыбозы і фасфатнай групы (фосфадыэфірныя сувязі). У пераважнай большасці выпадкаў (акрамя некаторых вірусаў, якія ўтрымліваюць адналанцужковую ДНК) макрамалекула ДНК складаецца з двух ланцугоў, арыентаваных азоцістымі асновамі адзін да аднаго. Гэтая двухланцужковая малекула спіралізавана. У цэлым структура малекулы ДНК атрымала назву «двайной спіралі».
У ДНК сустракаецца чатыры віды азоцістых асноў (адэнін, гуанін, тымін і цытазін). Азоцістыя асновы аднаго з ланцугой злучаюцца з азоцістымі асновамі другога ланцуга вадароднымі сувязямі згодна з прынцыпам камплементарнасці: адэнін злучаецца толькі з тымінам, гуанін — толькі з цытазінам. Паслядоўнасць нуклеатыдаў дазваляе «кадзіраваць» інфармацыю пра розныя тыпы РНК, найбольш важнымі з якіх з'яўляюцца інфармацыйныя, ці матрычныя (мРНК), рыбасомныя (рРНК) і транспартныя (тРНК). Усе гэтыя тыпы РНК сінтэзуюцца на матрыцы ДНК шляхам капіравання паслядоўнасці ДНК у паслядоўнасць РНК (у працэсе транскрыпцыі) і ўдзельнічаюць у біясінтэзе бялкоў (працэсе трансляцыі). Акрамя кадзіровачных паслядоўнасцей, ДНК клетак змяшчае паслядоўнасці, якія выконваюць рэгулятарныя і структурныя функцыі. Апрача таго, у геноме эўкарыёта часта сустракаюцца ўчасткі, якія належаць «генетычным паразітам», напрыклад, транспазонам.
Расшыфроўка структуры ДНК (1953 г.) стала адным з паваротных момантаў у гісторыі біялогіі. За выдатны ўклад у гэтае адкрыццё Фрэнсісу Крыку, Джеймсу Уотсану і Марысу Уілкінсу была прысуджана Нобелеўская прэмія па фізіялогіі і медыцыне 1962 года. Ключом для адкрыцця структуры ДНК паслужылі рэнтгенаграмы, атрыманыя даследчыцай Разалінд Франклін у 1952 годзе[1].
Гісторыя вывучэння[правіць | правіць зыходнік]
ДНК як хімічнае рэчыва была выдзелена Іаганам Фрыдрыхам Мішарам у 1868 годзе з рэшткаў клетак, якія змяшчаюцца ў гное. Ён вылучыў рэчыва, у склад якога ўваходзяць азот і фосфар. Спачатку новае рэчыва атрымала назву нуклеін, а пазней, калі Мішар вызначыў, што гэта рэчыва валодае кіслотнымі ўласцівасцямі, рэчыва атрымала назву нуклеінавая кіслата[2]. Біялагічная функцыя адкрытага рэчыва была не зразумелая, і доўгі час ДНК лічылася запаснікам фосфару ў арганізме. Больш за тое, нават у пачатку 20 стагоддзя многія біёлагі лічылі, што ДНК не мае ніякага дачынення да перадачы інфармацыі, паколькі будова малекулы, на іх думку, была занадта аднастайная і не магла трымаць закадзіраваную інфармацыю.
Паступова было даказана, што менавіта ДНК, а не бялкі, як лічылася раней, з'яўляецца носьбітам генетычнай інфармацыі. Адзін з першых вырашальных доказаў прынеслі эксперыменты О. Эверэ, Коліна Мак-Леада і Маклін Мак-Карці (1944) па трансфармацыі бактэрый. Ім удалося паказаць, што за так званую трансфармацыю (набыццё хваробатворных уласцівасцяў бясшкоднай культурай у выніку дадання ў яе мёртвых хваробатворных бактэрый) адказваюць выдзеленая з пнеўмакокаў ДНК. Эксперымент амерыканскіх навукоўцаў Алфрэда Херша і Марты Чэйз (эксперымент Херш—Чэйз, 1952) з пазначанымі радыеактыўнымі ізатопамі бялкоў і ДНК бактэрыяфагаў паказалі, што ў заражаную клетку перадаецца толькі нуклеінавая кіслата фага, а новае пакаленне фага ўтрымлівае такія ж бялкі і нуклеінавыя кіслоты, як зыходны фаг[3].
Да 50-х гадоў 20 стагоддзя дакладная будова ДНК, як і спосаб перадачы спадчыннай інфармацыі, заставалася невядомай. Хоць і было дакладна вядома, што ДНК складаецца з некалькіх ланцужкоў, якія складаюцца з нуклеатыдаў, ніхто не ведаў дакладна, колькі гэтых ланцугоў і як яны злучаны.
Структура двайной спіралі ДНК была прапанавана Фрэнсісам Крыкам і Джэймсам Уотсанам у 1953 годзе на падставе рэнтгенаструктурных дадзеных, атрыманых Марысам Уілкінсам і Разаліндай Франклін, і «правілаў Чаргафа», згодна з якімі ў кожнай малекуле ДНК выконваюцца строгія суадносіны, якія злучаюць паміж сабой колькасць азоцістых асноў розных тыпаў[4]. Пазней прапанаваная Уотсанам і Крыкам мадэль будовы ДНК была даказана, а іх праца адзначана Нобелеўскай прэміяй па фізіялогіі або медыцыне ў 1962 годзе. Сярод лаўрэатаў не было Разалінды Франклін, якая памерла да таго часу ад раку, бо прэмія не прысуджаецца пасмяротна[5].
Структура малекулы[правіць | правіць зыходнік]
Нуклеатыды[правіць | правіць зыходнік]
Дэзоксірыбануклеінавая кіслата (ДНК) уяўляе сабой біяпалімер (поліаніён), монамерам якога з'яўляецца нуклеатыд[6][7].
Кожны нуклеатыд складаецца з астатка фосфарнай кіслаты, які далучаны па 5-становішчу да цукру дэзоксірыбозы, да якога таксама праз гліказідную сувязь (C—N) па 1-становішчу далучана адна з чатырох азоцістых асноў. Менавіта наяўнасць характэрнага цукру і складае адно з галоўных адрозненняў паміж ДНК і РНК, зафіксаванае ў назвах гэтых нуклеінавых кіслот (у склад РНК уваходзіць цукар рыбоза)[8]. Прыклад нуклеатыда — адэназінмонафасфат, у якога асновай, далучанай да фасфату і рыбозы, з'яўляецца адэнін (паказаны на малюнку).
Зыходзячы з структуры малекул, асновы, якія ўваходзяць у склад нуклеатыдаў, падзяляюцца на дзве групы: пурыны (адэнін [A] і гуанін [G]) утвораны злучанымі пяці- і шасцічленным гетэрацыклам; пірымідзіны (цытазін [C] і тымін [T]) — шасцічленным гетэрацыклам[9].
У выглядзе выключэння, напрыклад, у бактэрыяфага PBS1, у ДНК сустракаецца пяты тып асноў — урацыл ([U]), пірымідзінавая аснова, якая адрозніваецца ад тыміна адсутнасцю метыльнай групы на кольцы, якая звычайна замяняе тымін у РНК[10].
Варта адзначыць, што тымін і ўрацыл не так строга прымеркаваны да ДНК і РНК адпаведна, як гэта лічылася раней. Так, пасля сінтэзу некаторых малекул РНК значная колькасць урацылаў у гэтых малекулах метыліруецца з дапамогай спецыяльных ферментаў, ператвараючыся ў тымін. Гэта адбываецца ў транспартных і рыбасомальных РНК[11].
Двайная спіраль[правіць | правіць зыходнік]

Палімер ДНК валодае даволі складанай структурай. Нуклеатыды злучаны паміж сабой кавалентна ў доўгія полінуклеатыдныя ланцугі. Гэтыя ланцугі ў большасці выпадкаў (акрамя некаторых вірусаў, якія валодаюць адналанцуговымі ДНК-геномамі) аб'ядноўваюцца парамі пры дапамозе вадародных сувязяў ва другасную структуру, якая атрымала назву двайной спіралі[4][8]. Аснова кожнага з ланцугоў складаецца з фасфатаў і цукроў, якія чаргуюцца[12]. Унутры аднаго ланцуга ДНК суседнія нуклеатыды злучаны фосфадыэфірнымі сувязямі, якія фарміруюцца ў выніку ўзаемадзеяння паміж 3'-гідраксільнай (3'—ОН) групай малекулы дэзоксірыбозы аднаго нукдеатыда і 5'-фасфатнай групай (5'—РО3) другога. Асіметрычныя канцы ланцуга ДНК называюцца 3' (тры прым) і 5' (пяць прым). Палярнасць ланцуга грае важную ролю пры сінтэзе ДНК (падаўжэнне ланцуга магчыма толькі шляхам далучэння новых нуклеатыдаў да свабоднага 3'-канца).
Як ужо было адзначана вышэй, у пераважнай большасці жывых арганізмаў ДНК складаецца не з аднаго, а з двух полінуклеатыдных ланцугоў. Гэтыя два доўгія ланцугі закручаныя адзін вакол другога ў выглядзе двайной спіралі, стабілізаванай вадароднымі сувязямі, якія ўтвараюцца паміж звернутых адна да адной азоцістымі асновамі, якія ўваходзяць у склад ланцугоў. У прыродзе гэта спіраль, часцей за ўсё, правазакручаная. Напрамкі ад 3'-канца да 5'-канца ў двух ланцугах, з якіх складаецца малекула ДНК, супрацьлеглыя (ланцугі «антыпаралельны» адзін аднаму).
Шырыня двайны спіралі складае ад 22 да 24 Å, або 2,2 — 2,4 нм, даўжыня кожнага нуклеатыда 3,3 Å (0,33 нм)[13]. Падобна таму, як у вінтавой лесвіцы збоку можна ўбачыць прыступкі, на двайны спіралі ДНК у прамежках паміж фасфатным астовам малекулы можна бачыць рэбры асноў, кольцы якіх размешчаны ў плоскасці, перпендыкулярнай у адносінах да падоўжнай восі макрамалекулы.
У двайной спіралі адрозніваюць малую (12 Å) і вялікую (22 Å) баразёнкі[14]. Бялкі, напрыклад, фактары транскрыпцыі, якія далучаюцца да пэўных паслядоўнасцяў у двухланцужковай ДНК, звычайна ўзаемадзейнічаюць з краямі асноў у вялікай баразёнцы, дзе тыя больш даступныя[15].
Утварэнне сувязяў паміж асновамі[правіць | правіць зыходнік]
Кожная аснова на адным з ланцугоў звязваецца з адной пэўнай асновай на другім ланцугу. Такое спецыфічнае звязванне называецца камплементарным. Пурыны камплементарны пірымідзінам (гэта значыць, яны здольны да ўтварэння вадародных сувязяў з імі): адэнін утварае сувязі толькі з тымінам, а цытазін — з гуанінам. У двайной спіралі ланцужкі таксама звязаны з дапамогай гідрафобных узаемадзеянняў і стэкінга, якія не залежаць ад паслядоўнасці асноў ДНК [16].
Камплементарнасць двайной спіралі азначае, што інфармацыя, якая змяшчаецца ў адным ланцугу, утрымліваецца і ў другім ланцугу. Зварачальнасць і спецыфічнасць узаемадзеянняў паміж камплементарнымі парамі асноў важны для рэплікацыі ДНК і ўсіх астатніх функцый ДНК у жывых арганізмах.
Вадародныя сувязі лёгка разрываюцца і аднаўляюцца, бо яны некавалентны. Ланцужкі двайной спіралі могуць разыходзіцца як замок-маланка пад дзеяннем ферментаў (хеліказы) або пры высокай тэмпературы[17]. Розныя пары асноў утвараюць розную колькасць вадародных сувязяў. АТ звязаны дзвюма, ГЦ — трыма вадароднымі сувязямі, таму на разрыў ГЦ патрабуецца больш энергіі. Працэнт ГЦ-пар і даўжыня малекулы ДНК вызначаюць колькасць энергіі, неабходнай для дысацыяцыі ланцугоў: доўгія малекулы ДНК з вялікім утрыманнем ГЦ больш тугаплаўкія[18].
Часткі малекул ДНК, якія з-за іх функцый павінны быць лёгка разделяемы, напрыклад ТАТА паслядоўнасць у бактэрыяльных праматорах, звычайна ўтрымліваюць вялікую колькасць А і Т.
Хімічныя мадыфікацыі асноў[правіць | правіць зыходнік]

|

|

|
| Цытазін | 5-метылцытазін | Тымін |
Азоцістыя асновы ў складзе ДНК могуць быць кавалентна мадыфікаваны, што выкарыстоўваецца пры рэгуляцыі экспрэсіі генаў. Напрыклад, у клетках пазваночных метыліраванне цытазіна з утварэннем 5-метылцытазіна выкарыстоўваецца саматычнымі клеткамі для перадачы профілю геннай экспрэсіі даччыным клеткам. Метыліраванне цытазіна не ўплывае на спарванне асноў у двайной спіралі ДНК. У пазваночных метыліраванне ДНК у саматычных клетках абмяжоўваецца метыліраваннем цытазіна ў паслядоўнасці ЦГ[19]. Сярэдні ўзровень метыліравання адрозніваецца ў розных арганізмаў, так, у нематоды Caenorhabditis elegans метыліраванне цытазіна не назіраецца, а ў пазваночных выяўлены высокі ўзровень метыліравання — да 1 %[20]. Іншыя мадыфікацыі асноў уключаюць метыліраванне адэніна ў бактэрый і гліказіліраванне ўрацыла з утварэннем «J-асновы» у кінетапластах[21].
Метыліраванне цытазіна з утварэннем 5-метылцытазіна ў праматорнай часткі гена карэлюе з яго неактыўным станам[22]. Метыліраванне цытазіна важна таксама для інактывацыі Х-храмасомы ў млекакормячых[23]. Метыліраванне ДНК выкарыстоўваецца ў геномным імпрынтынге[24]. Значныя парушэнні профілю метыліравання ДНК адбываецца пры канцерагенезе[25].
Нягледзячы на біялагічную ролю, 5-метылцытазін можа спантанна страчваць амінную агрупу (дэамініравацца), ператвараючыся ў тымін, таму метыліраванныя цытазіны з'яўляюцца крыніцай павышанай колькасці мутацый[26].
Пашкоджанні ДНК[правіць | правіць зыходнік]
ДНК можа пашкоджвацца разнастайнымі мутагенамі, да якіх адносяцца акісляючыя і алкіліруючыя рэчывы, а таксама высокаэнергетычная электрамагнітная радыяцыя — ультрафіялетавае і рэнтгенаўскае выпраменьванні. Тып пашкоджанні ДНК залежыць ад тыпу мутагена. Напрыклад, ультрафіялет пашкоджвае ДНК шляхам утварэння ў ёй дымераў тыміна, якія ўзнікаюць пры стварэнні кавалентных сувязяў паміж суседнімі асновамі[28].
Аксіданты, такія як свабодныя радыкалы або пераксід вадароду, прыводзяць да некалькіх тыпах пашкоджанні ДНК, уключаючы мадыфікацыі асноў, у асаблівасці гуаназіна, а таксама двухланцужковыя парывы ў ДНК[29]. Згодна некаторым ацэнкам, у кожнай клетцы чалавека акісляючымі злучэннямі штодня пашкоджваецца каля 500 асноў[30][31]. Сярод розных тыпаў пашкоджанняў найбольш небяспечныя — гэта двухланцужковыя парывы, таму што яны цяжка рэпарыруюцца і могуць прывесці да страт участкаў храмасом (дзелецыям) і транслакацыям.
Многія малекулы мутагенаў устаўляюцца (інтэркаліруюць) паміж двума суседнімі парамі асноў. Большасць гэтых злучэнняў, напрыклад, этыдый, даўнарубіцын, доксарубіцын і талідамід маюць араматычную структуру. Для таго, каб інтэркаліруючае злучэнне магло змясціцца паміж асновамі, яны павінны разысціся, расплетаяючы і парушаючы структуру двайной спіралі. Гэтыя змены ў структуры ДНК перашкаджаюць транскрыпцыі і рэплікацыі, выклікаючы мутацыі. Таму інтэркаліруючыя злучэнні часта з'яўляюцца канцэрагенамі, найбольш вядомыя з якіх — бензапірэн, акрыдзіны, афлатаксін і бромісты этыдый[32][33][34]. Нягледзячы на гэтыя негатыўныя ўласцівасці, з-за іх здольнасці прыгнятаць транскрыпцыю і рэплікацыю ДНК, інтэркаліруючыя злучэнні выкарыстоўваюцца ў хіміятэрапіі для падаўлення клетак рака, якія хутка растуць[35].
Суперскручанасць[правіць | правіць зыходнік]
Калі ўзяцца за канцы вяроўкі і пачаць скручваць іх у розныя бакі, яна становіцца карацей, і на вяроўцы ўтвараюцца «супервіткі». Гэтак жа можа быць суперскручана і ДНК. У звычайным стане ланцужок ДНК робіць адзін абарот на кожныя 10,4 асновы, але ў суперскручаным стане спіраль можа быць згорнутая тужэй або можа быць расплеценай[36]. Вылучаюць два тыпа суперскручвання: станоўчае — у кірунку нармальных віткоў, пры якім асновы размешчаны бліжэй адна да адной; і адмоўнае — у процілеглым кірунку. У прыродзе малекулы ДНК звычайна знаходзяцца ў адмоўным суперскручванні, якое ўносіцца ферментамі — тапаізамеразамі[37]. Гэтыя ферменты выдаляюць дадатковае скручванне, якое ўзнікае ў ДНК у выніку транскрыпцыі і рэплікацыі[38].

Структуры на канцах храмасом[правіць | правіць зыходнік]
На канцах лінейных храмасом знаходзяцца спецыялізаваныя структуры ДНК, якія называюцца целамерамі. Асноўная функцыя гэтых участкаў — падтрыманне цэласнасці канцоў храмасом[40]. Целамеры таксама абараняюць канцы ДНК ад дэградацыі экзануклеазамі і прадухіляюць актывацыю сістэмы рэпарацыі[41]. Паколькі звычайныя ДНК-полімеразы не могуць репліцыраваць 3' канцы храмасом, гэта робіць адмысловы фермент — целамераза.
У клетках чалавека целамеры часта прадстаўлены адналанцужковай ДНК і складаюцца з некалькіх тысяч паўтаральных адзінак паслядоўнасці ТТАГГГ[42]. Гэтыя паслядоўнасці з высокім утрыманнем гуаніна стабілізуюць канцы храмасом, фарміруючы вельмі незвычайныя структуры, — G-квадруплексамі — якія складаюцца з чатырох, а не двух, асноў, якія ўзаемадзейнічаюць. Чатыры гуанінавыя асновы, усе атамы якіх знаходзяцца ў адной плоскасці, утвараюць пласцінку, стабілізаванную вадароднымі сувязямі паміж асновамі і хелаціраваннем у цэнтры яе іона металу (часцей за ўсё калія). Гэтыя пласцінкі размяшчаюцца стосікам адна за адной[43]
На канцах храмасом могуць утварацца і іншыя структуры: асновы могуць быць размешчаны ў адным ланцужку або ў розных паралельных ланцужках. Акрамя гэтых «стосікавых» структур целамуры ўтвараюць вялікія петлепадобная структуры — Т-завесы, або целамерныя завесы. У іх адналанцужковая ДНК размяшчаецца ў выглядзе шырокага кальца, стабілізаванага целамернымі бялкамі[44]. У канцы Т-завесы адналанцужковая целамерная ДНК далучаецца да двухланцужковай ДНК, парушаючы спарванне ланцужкоў у гэтай малекуле і ўтвараючы сувязі з адным з ланцугоў. Гэта трохланцужковае ўтварэнне называецца Д-пятля (ад англ.: displacement loop)[43].
Біялагічныя функцыі[правіць | правіць зыходнік]
ДНК з'яўляецца носьбітам генетычнай інфармацыі, запісанай у выглядзе паслядоўнасці нуклеатыдаў з дапамогай генетычнага кода. З малекуламі ДНК звязаны дзве асноватворныя ўласцівасці жывых арганізмаў — спадчыннасць і зменлівасць. У ходзе працэсу рэплікацыі ДНК утвараюцца дзве копіі зыходнага ланцужка, якія атрымліваюць у спадчыну даччыныя клеткі пры дзяленні, такім чынам атрымаўшыяся клеткі аказваюцца генетычна ідэнтычныя зыходнай.
Генетычная інфармацыя рэалізуецца пры экспрэсіі генаў у працэсах транскрыпцыі (сінтэзу малекул РНК на матрыцы ДНК) і трансляцыі (сінтэзу бялкоў на матрыцы РНК).
Паслядоўнасць нуклеатыдаў «кадуе» інфармацыю аб розных тыпах РНК: інфармацыйных, або матрычных (мРНК), рыбасамальных (рРНК) і транспартных (тРНК). Усе гэтыя тыпы РНК сінтэзуюцца на аснове ДНК у працэсе транскрыпцыі. Ролю іх у біясінтэзе бялкоў (працэсе трансляцыі) розная. Інфармацыйная РНК змяшчае інфармацыю аб паслядоўнасці амінакіслот у бялку, рыбасамальныя РНК служаць асновай для рыбасом (складаных нуклеапратэінавых комплексаў, асноўная функцыя якіх — зборка бялку з асобных амінакіслот на аснове іРНК), транспартныя РНК дастаўляюць амінакіслоты да месца зборкі бялкоў — у актыўны цэнтр рыбасомы, якая «паўзе» па іРНК.
Гл. таксама[правіць | правіць зыходнік]
Зноскі
- ↑ Erica Westly. No Nobel for You: Top 10 Nobel Snubs. Rosalind Franklin--her work on the structure of DNA never received a Nobel (англ.). Scientific American (6 кастрычніка 2008). Архівавана з першакрыніцы 8 студзеня 2014. Праверана 18 лістапада 2013.
- ↑ Dahm R (2005). "Friedrich Miescher and the discovery of DNA". Dev Biol. 278 (2): 274–88. PMID 15680349.
- ↑ Hershey A, Chase M (1952). "Independent functions of viral protein and nucleic acid in growth of bacteriophage" (PDF). J Gen Physiol. 36 (1): 39–56. PMID 12981234.
- ↑ а б Watson J, Crick F (1953). "Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid" (PDF). Nature. 171 (4356): 737–8. PMID 13054692.
- ↑ The Nobel Prize in Physiology or Medicine 1962 Nobelprize .org Accessed 22 Dec 06
- ↑ Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. Molecular Biology of the Cell; Fourth Edition. — New York and London: Garland Science, 2002.
- ↑ Butler, John M. (2001) Forensic DNA Typing «Elsevier». С. 14 — 15. ISBN 978-0-12-147951-0
- ↑ а б Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ↑ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
- ↑ Takahashi I, Marmur J. (1963). "Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis". Nature. 197: 794–5. PMID 13980287.
- ↑ Agris P (2004). "Decoding the genome: a modified view". Nucleic Acids Res. 32 (1): 223–38. PMID 14715921.
- ↑ Ghosh A, Bansal M (2003). "A glossary of DNA structures from A to Z". Acta Crystallogr D Biol Crystallogr. 59 (Pt 4): 620–6. PMID 12657780.
- ↑ Mandelkern M, Elias J, Eden D, Crothers D (1981). "The dimensions of DNA in solution". J Mol Biol. 152 (1): 153–61. PMID 7338906.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R (1980). "Crystal structure analysis of a complete turn of B-DNA". Nature. 287 (5784): 755–8. PMID 7432492.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Pabo C, Sauer R. "Protein-DNA recognition". Annu Rev Biochem. 53: 293–321. PMID 6236744.
- ↑ Ponnuswamy P, Gromiha M (1994). "On the conformational stability of oligonucleotide duplexes and tRNA molecules". J Theor Biol. 169 (4): 419–32. PMID 7526075.
- ↑ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub H (2000). "Mechanical stability of single DNA molecules". Biophys J. 78 (4): 1997–2007. PMID 10733978.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Chalikian T, Völker J, Plum G, Breslauer K (1999). "A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques". Proc Natl Acad Sci U S A. 96 (14): 7853–8. PMID 10393911.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и др. — М.-Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — Т. I. — С. 719-733. — 808 с. — ISBN 978-5-4344-0112-8.
- ↑ Bird A (2002). "DNA methylation patterns and epigenetic memory". Genes Dev. 16 (1): 6–21. PMID 11782440.
- ↑ Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P, Borst P (1993). "beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei". Cell. 75 (6): 1129–36. PMID 8261512.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Jones P. A. Functions of DNA methylation: islands, start sites, gene bodies and beyond // Nature Reviews Genetics. — 2012. — Т. 13. — № 7. — С. 484—492.
- ↑ Klose R, Bird A (2006). "Genomic DNA methylation: the mark and its mediators". Trends Biochem Sci. 31 (2): 89–97. PMID 16403636.
- ↑ Li E., Beard C., Jaenisch R. Role for DNA methylation in genomic imprinting //Nature. — 1993. — Т. 366. — №. 6453. — С. 362—365
- ↑ Ehrlich M. DNA methylation in cancer: too much, but also too little //Oncogene. — 2002. — Т. 21. — №. 35. — С. 5400-5413
- ↑ Walsh C, Xu G. "Cytosine methylation and DNA repair". Curr Top Microbiol Immunol. 301: 283–315. PMID 16570853.
- ↑ Created from PDB 1JDG Архівавана 22 верасня 2008.
- ↑ Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). "Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation". Biochemistry. 42 (30): 9221–6. PMID 12885257.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S (1999). "Hydroxyl radicals and DNA base damage". Mutat Res. 424 (1–2): 9–21. PMID 10064846.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Shigenaga M, Gimeno C, Ames B (1989). "Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage". Proc Natl Acad Sci U S A. 86 (24): 9697–701. PMID 2602371.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) Архіўная копія. Архівавана з першакрыніцы 7 сакавіка 2008. Праверана 15 лютага 2015. - ↑ Cathcart R, Schwiers E, Saul R, Ames B (1984). "Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage" (PDF). Proc Natl Acad Sci U S A. 81 (18): 5633–7. PMID 6592579.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) Архіўная копія. Архівавана з першакрыніцы 25 чэрвеня 2008. Праверана 15 лютага 2015. - ↑ Ferguson L, Denny W (1991). "The genetic toxicology of acridines". Mutat Res. 258 (2): 123–60. PMID 1881402.
- ↑ Jeffrey A (1985). "DNA modification by chemical carcinogens". Pharmacol Ther. 28 (2): 237–72. PMID 3936066.
- ↑ Stephens T, Bunde C, Fillmore B (2000). "Mechanism of action in thalidomide teratogenesis". Biochem Pharmacol. 59 (12): 1489–99. PMID 10799645.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). "Intercalators as anticancer drugs". Curr Pharm Des. 7 (17): 1745–80. PMID 11562309.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Benham C, Mielke S (2005). "DNA mechanics". Annu Rev Biomed Eng. 7: 21–53. PMID 16004565.
- ↑ Champoux J (2001). "DNA topoisomerases: structure, function, and mechanism". Annu Rev Biochem. 70: 369–413. PMID 11395412.
- ↑ Wang J (2002). "Cellular roles of DNA topoisomerases: a molecular perspective". Nat Rev Mol Cell Biol. 3 (6): 430–40. PMID 12042765.
- ↑ Created from NDB UD0017 Архівавана 7 чэрвеня 2013.
- ↑ Greider C, Blackburn E (1985). "Identification of a specific telomere terminal transferase activity in Tetrahymena extracts". Cell. 43 (2 Pt 1): 405–13. PMID 3907856.
- ↑ Nugent C, Lundblad V (1998). "The telomerase reverse transcriptase: components and regulation". Genes Dev. 12 (8): 1073–85. PMID 9553037.
- ↑ Wright W, Tesmer V, Huffman K, Levene S, Shay J (1997). "Normal human chromosomes have long G-rich telomeric overhangs at one end". Genes Dev. 11 (21): 2801–9. PMID 9353250.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ а б Burge S, Parkinson G, Hazel P, Todd A, Neidle S (2006). "Quadruplex DNA: sequence, topology and structure". Nucleic Acids Res. 34 (19): 5402–15. PMID 17012276.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) - ↑ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T (1999). "Mammalian telomeres end in a large duplex loop". Cell. 97 (4): 503–14. PMID 10338214.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link)
Літаратура[правіць | правіць зыходнік]
| Дэзоксірыбануклеінавая кіслата на Вікісховішчы |
- Дэзоксірыбануклеінавая кіслата // Беларуская энцыклапедыя: У 18 т. Т. 6: Дадаізм — Застава / Рэдкал.: Г. П. Пашкоў і інш. — Мн.: БелЭн, 1998. — Т. 6. — С. 327. — 576 с. — ISBN 985-11-0106-0 (Т. 6).