Сінільная кіслата
| Сінільная кіслата | |
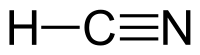
| |

| |

| |
| Агульныя | |
|---|---|
| Традыцыйныя назвы | цыянавадарод, сінільная кіслата |
| Хім. формула | HCN |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | бясколерны газ ці бясколерная легкалятучая вадкасць |
| Малярная маса | 27,0253 г/моль |
| Шчыльнасць | 0,687 г/см³ |
| Дынамічная вязкасць (ст. ум.) | 0,201 Па·с (пры 20 °C) |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | -13,4 °C |
| Тэмпература кіпення | 26,7 °C |
| Тэмпература ўспышкі | -17,8 °C |
| Малярная цеплаёмістасць (ст. ум.) | (сярэдняя для газу і вадкасці) 1,97 Дж/(моль·К) |
| Хімічныя ўласцівасці | |
| pKa | 9,21 |
| Растваральнасць у вадзе | у любых прапорцыях |
| Аптычныя ўласцівасці | |
| Паказчык пераламлення | 1,2675 |
| Структура | |
| Дыпольны момант | 2,98 Д |
| Класіфікацыя | |
| Рэг. нумар CAS | |
| PubChem | |
| Рэг. нумар EINECS | 200-821-6 |
| SMILES | |
| Рэг. нумар EC | 200-821-6 |
| RTECS | MW6825000 |
| ChemSpider | |
| Бяспека | |
| ЛД50 | мышы (пэраральна) 3.7 мг/кг |
| Таксічнасць | |
Сіні́льная (цыяніставадародная) кіслата, цыяністы вадарод, нітрыл мурашынай кіслаты, HCN — аднаасноўная кіслата. Адкрыта ў 1782 годзе шведскім хімікам К. В. Шэеле, у 1811 годзе Ж. Л. Гей-Люсак атрымаў бязводную сінільную кіслату і вызначыў яе склад[1].
Бескаляровая, вельмі лятучая, лёгкарухомая атрутная вадкасць з характэрным пахам горкага міндалю. Тэмпература кіпення 25,65 °C, шчыльнасць 687,08 кг/м³. Сумесь пары з паветрам (4,9—39,7 % кіслаты) выбуханебяспечная. Змешваецца ва ўсіх адносінах з вадой, этанолам, дыэтылавым эфірам. Узаемадзейнічае з аксідамі і гідраксідамі шчолачных і шчолачназямельных металаў. Не ўзаемадзейнічае з карбанатамі.
Сінільная кіслата ўтрымліваецца ў некаторых раслінах (гл. цыянідная бомба), коксавым газе, тытунёвым дыме, вылучаецца пры тэрмічным раскладанні нейлону, поліурэтанаў.
З металамі ўтварае солі — цыяніды. Арганічныя вытворныя сінільнай кіслаты маюць назву нітрылы.
Асноўны метад атрымання ў прамысловасці — акісляльны аманоліз метану пры тэмпературы 1000 °C на каталізатары (плаціна, сплавы плаціны з родыем і плаціны з ірыдыем)[2].
Сінільная кіслата выкарыстоўваецца у вытворчасці цыянідаў, хлорцыяну, акрылатаў, амінакіслот, у якасці фуміганта і інш.
Зноскі
- ↑ [Синильная кислота (руск.)] — артыкул з Вялікай савецкай энцыклапедыі
- ↑ Смирнов С. К. Синильная кислота (руск.)
Літаратура
[правіць | правіць зыходнік]- Сінільная кіслата // Беларуская энцыклапедыя: У 18 т. Т. 14: Рэле — Слаявіна / Рэдкал.: Г. П. Пашкоў і інш. — Мн. : БелЭн, 2002. — Т. 14. — С. 400. — 10 000 экз. — ISBN 985-11-0035-8. — ISBN 985-11-0238-5 (т. 14).
- Хімічны слоўнік навучэнца: Дапаможнік для вучняў / Б. Н. Качаргін, В. М. Макарэўскі, Л. Я. Гарнастаева, В. С. Аранская. — Мн.: Народная асвета, 2003. — С. 214. — 287 с. — 1 000 экз. — ISBN 985-12-0621-8.
- Синильная кислота // Большая советская энциклопедия : ([в 30 т.]) / гл. ред. А. М. Прохоров. — 3-е изд.. — М. : Советская энциклопедия, 1969—1978. (руск.)
- Синильная кислота // Российская энциклопедия по охране труда: В 3 т. — 2-е изд., перераб. и доп. — М.: Изд-во НЦ ЭНАС,2007. (руск.)
Спасылкі
[правіць | правіць зыходнік]- Смирнов С. К. Синильная кислота (руск.)

