Вада
| Вада | |

| |
| |

| |
| Агульныя | |
|---|---|
| Сістэматычнае найменне | Аксід вадароду Вода[1] |
| Традыцыйныя назвы | вада |
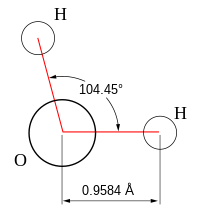
| Хім. формула | Н2O |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | вадкасць |
| Малярная маса | 18,01528 г/моль |
| Шчыльнасць | 0,9982 г/см³ |
| Дынамічная вязкасць (ст. ум.) | 0,00101 Па·с (пры 20 °C) |
| Кінематычная вязкасць (ст. ум.) | 0,01012 см²/с (при 20 °C) |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | 0 °C |
| Тэмпература кіпення | 99,974 °C |
| Патройны пункт | 0,01 °C, 611,73 Па |
| Крытычны пункт | 374 °C, 22,064 МПа |
| Малярная цеплаёмістасць (ст. ум.) | 75,37 Дж/(моль·К) |
| Цеплаправоднасць (ст. ум.) | 0,56 Вт/(м·K) |
| Класіфікацыя | |
| Рэг. нумар CAS | |
| PubChem | |
| Рэг. нумар EINECS | 231-791-2 |
| SMILES | |
| RTECS | ZC0110000 |
| ChemSpider | |

Вада́, або монааксід вадароду (H2O) — найпрасцейшае ўстойлівае злучэнне вадароду з кіслародам.
Старажытныя філосафы лічылі ваду адным з чатырох першасных элементаў. Такія ўяўленні існавалі і ў Сярэднявеччы. Утварэнне вады пры згаранні вадароду было даведзена Г. Кавендышам (1781). Хімічная формула была канчаткова ўстаноўленая С. Каніцара (1860).
Фізіка
[правіць | правіць зыходнік]Фізічна пры нармальных умовах: празрыстая бясколерная (у тоўстым слоі блакітная) вадкасць, без паху і смаку. Тэмпература замярзання 0 °C, кіпення 100 °C. Найбольшая шчыльнасць 1000 кг/м³ (пры 4 °C). Распад малекул адбываецца пры 1000 °C.
Пры павелічэнні або памяншэнні тэмпературы ў вадкім стане шчыльнасць памяншаецца. Пры наяўнасці ў вадзе раствораных нелятучых злучэнняў (як соль ці цукар) ціск пары і тэмпература замярзання паніжаюцца, а тэмпература кіпення павышаецца.
Чыстая вада слаба праводзіць электрычны ток, але робіцца добрым правадніком пры растварэнні ў ёй нават невялікіх колькасцей іонных рэчываў.
Хімія
[правіць | правіць зыходнік]Вада мае амфатэрныя якасці (можа выступаць і як кіслата, і як аснова).
Вада з’яўляецца добрым растваральнікам, асабліва для іонных сувязяў, і для многіх кавалентных злучэнняў, неметалаў, соляў, вокісаў).
Актыўна рэагуе з металамі. Акісляе металы, вышэйшыя за волава ў электрахімічным радзе напружанняў, удзельнічае такім чынам у працэсах карозіі.
Дзейнічае як аднаўляльнік у шэрагу біяхімічных працэсаў, у т.л. пры фотасінтэзе.
Удзельнічае таксама ў рэакцыях кіслотна-асноўных, гідратацыі, гідролізу.
У прыродзе
[правіць | правіць зыходнік]Найбольш распаўсюджанае хімічнае злучэнне на Зямлі. Агульная маса вады на планеце дасягае 1018 т, і ёю пакрытыя каля 4/5 зямной паверхні. Неабходнае рэчыва для існавання жыцця. Чалавечае цела на 2/3 складаецца з вады, пераважна з вады складаюцца шмат якія харчовыя прадукты. Прэсная вада складае каля 3 % зямных запасаў, з гэтага каля 80 % недаступныя для выкарыстання, бо знаходзяцца ў палярных шапках.
Адметнасці
[правіць | правіць зыходнік]Адзінае хімічнае злучэнне, якое ў прыродных умовах існуе ў трох агрэгатных станах: вадкасці, цвёрдага рэчыва (лёд) і газу (вадзянай пары).
Вада мае шэраг досыць незвычайных для хімічных рэчываў асаблівасцей, напрыклад, досыць высокія тэмпературы замярзання і кіпення, высокі каэфіцыент паверхневага нацягнення, найбольшую шчыльнасць у вадкім агрэгатным стане, большую за шчыльнасць у цвёрдым. Гэта тлумачыцца існаваннем у вадзе вадародных сувязяў, якія звязваюць малекулы між сабой як у вадкім так і ў цвёрдым станах. Вада з’яўляецца кавалентным малекулярным злучэннем.
Гл. таксама
[правіць | правіць зыходнік]Зноскі
Літаратура
[правіць | правіць зыходнік]- Michael Freemantle. Chemistry in Action. London, Macmillan Education, 1987. У выданні: Фримантл М. Химия в действии. В 2-х ч. : Пер. с англ. — М.: Мир, 1991. ISBN 5-03-000935-3. Т.2 С.51—54.
Спасылкі
[правіць | правіць зыходнік] На Вікісховішчы ёсць медыяфайлы па тэме Вада
На Вікісховішчы ёсць медыяфайлы па тэме Вада- Дыяграма фазавых станаў (англ.)
