Хвароба Паркінсона
| Хвароба Паркінсона | |
|---|---|
 Пацыент з хваробай Паркінсона. Малюнак з падручніка 1886 года Вільяма Говерса. | |
| МКХ-10 | G20. |
| МКБ-10-КМ | G20 і F02.3 |
| МКХ-9 | 332 |
| МКБ-9-КМ | 332.0[1][2] і 332[1][2] |
| OMIM | 168600 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine | neuro/304 |
| MeSH | D010300 |
Хваро́ба Паркінсо́на[3], або Хваро́ба Па́ркінсана[4], або І́дыяпаты́чны дрыжа́льны пара́ліч — павольна прагрэсіруючае хранічнае неўралагічнае захворванне, характэрнае для асоб старэйшай узроставай групы. Адносіцца да дэгенератыўных хвароб экстрапіраміднай маторнай сістэмы. У патагенезе галоўная роля адводзіцца разбурэнню і гібелі нейронаў, выпрацоўваючых нейрамедыятар дафамін, асабліва ў чорнай субстанцыі, але таксама і ў іншых аддзелах цэнтральнай нервовай сістэмы. Недастатковая выпрацоўка дафаміну павялічвае ўплыў базальных гангліяў на кару галаўнога мозга.
Асноўнымі сімптомамі з'яўляюцца:
- цягліцавая рыгіднасць;
- гіпакінезія;
- трэмар;
- пастуральная няўстойлівасць.
Сучасная медыцына пакуль што не можа вылечыць захворванне або значна запаволіць яго прагрэсіраванне (этыялагічная або патагенетычная тэрапія немагчымая), аднак існуючыя метады кансерватыўнага і хірургічнага лячэння дазваляюць значна палепшыць якасць жыцця хворых[5].
Тэрмін «паркінсанізм» з'яўляецца агульным для шэрагу захворванняў і станаў з вышэй названымі сімптомамі. Аднак найбольш значнай формай паркінсанізму з'яўляецца менавіта хвароба Паркінсона — ідыяпатычнае захворванне (г. зн. самастойная хвароба, якая не выклікаецца іншымі).
Назва хваробе дадзена французскім неўролагам Жанам Мартэнам Шарко, які прапанаваў ушанаваць такім чынам імя англійскага ўрача Джэймса Паркінсона — чалавека, які ўпершыню грунтоўна апісаў хваробу ў «Эсэ аб дрыжальным паралічу», аднак не быў належным чынам ацэнены пры жыцці.
Гісторыя даследавання[правіць | правіць зыходнік]



Праявы хваробы Паркінсона былі апісаныя за некалькі тысячагоддзяў да публікацыі ў 1817 годзе Джэймсам Паркінсонам «Эсэ аб дрыжальным паралічу» (англ.: An Essay on the Shaking Palsy).
У егіпецкім папірусе XII ст. да н. э. у аднаго з фараонаў адзначаюцца характэрныя для захворвання сімптомы. У Бібліі апісваюцца людзі з трэмарам[6][7]. У тэкстах Аюрведы захворванне, якое выяўляецца трэмарам, абмежаваннем рухаў, слінацячэннем і іншымі характэрнымі сімптомамі, рэкамендавана лячыць некаторымі відамі бабовых. Знакаміты старажытнарымскі ўрач Гален, хутчэй за ўсё, яшчэ ў II ст. н. э. апісаў хваробу Паркінсона, указаўшы на яе сімптомы — трэмар спакою, пастуральную няўстойлівасць і цягліцавую рыгіднасць[7][8].
Пасля Галена сімптомы паркінсанізму зноў былі апісаныя толькі ў XVII ст[7]. Галандскі ўрач і анатам Францыск Сільвій адзначыў адрозненне трэмару спакою ад іншых відаў дрыжання, немец Іеранім Гобій вылучыў сімптомы характэрнай для паркінсанізму хады[7][8][9]. Знакаміты шатландскі хірург Джон Хантэр даў падрабязнае апісанне хворага на паркінсанізм[7][10].
У 1817 годзе англійскі ўрач Джэймс Паркінсон апублікаваў «Эсэ аб дрыжальным паралічу»[6]. У ім ён апісаў шэсць хворых людзей, падрабязны спыніўшыся на такіх характэрных сімптомах захворвання, як трэмар спакою, паталагічная хада і пастуральная няўстойлівасць, цягліцавая рыгіднасць і інш. Таксама ён ацаніў іх дынаміку пры прагрэсіраванні хваробы[6][11]. Праца заставалася незаўважанай ажно на працягу 40 гадоў пасля апублікавання[11]. Класічныя даследаванні неўролагаў Вільяма Говерса, Сэмюеля Вільсана, Вільгельма Эрба і Жана Мартэна Шарко ў 1868—1881 гадах дазволілі вылучыць хваробу Паркінсона як самастойнае захворванне. Па прапанове знакамітага французскага неўролага Шарко захворванне атрымала імя брытанскага ўрача Паркінсона, праца якога не была годным чынам адзначана пры жыцці[6].
Пасля вызнання хваробы Паркінсона за самастойнае захворванне паўстала пытанне аб тым, пашкоджанне якіх структур вядзе да яго сімптомаў. Французскі неўролаг Эдуард Брысо ў канцы XIX ст. зрабіў здагадку, што за развіццё захворвання адказныя субталамічнае ядро і ножкі мозга (аддзел сярэдняга мозга)[6]. У 1912 годзе Фрэдэрык Генры Леві знайшоў спецыфічныя ўключэнні ў клетках ствала мозга, характэрныя для хваробы Паркінсона, якія ў будучыні атрымаюць назву «цельцы Леві»[6]. У 1919 годзе рускі неўролаг Канстанцін Мікалаевіч Трацьякоў вызначыў, што асноўныя паталагічныя змены пры захворванні ўзнікаюць у чорнай субстанцыі[12]. Здагадкі К. М. Трацьякова не вызнаваліся медыцынскай грамадою за існыя ажно да марфалагічнага пацверджання іх нямецкім патолагаанатамам Рольфам Хаслерам у 1948 годзе[6][13].
Біяхімічныя змены, якія ляжаць у аснове захворвання, сталі даследаваць у 1950-х гадах. За даследаванні нейратрансмітара дафаміну, які грае важную ролю ў развіцці хваробы, шведскі фармаколаг Арвід Карлсан атрымаў Нобелеўскую прэмію па фізіялогіі і медыцыне[14] ў 2000 г. Склад цельцаў Леві быў расшыфраваны ў 1997 годзе[15].
Разам з даследаваннямі прыроды захворвання развіваліся і метады яго лячэння. Неўролагі канца XIX — пачатку XX стагоддзяў адзначалі станоўчы эфект алкалоідаў групы атрапіну беладонны. У 1939 г. мела месца спроба хірургічнага лячэння — дэструкцыя базальных гангліяў. Гэтыя методыкі былі ўдасканалены за наступныя 20 гадоў[8]. Да ўкаранення ў клінічную практыку левадопы антыхалінергічныя прэпараты і хірургічнае разбурэнне базальных ядраў заставаліся асноўнымі метадамі лячэння хваробы Паркінсона. У канцы 1980-х гадоў стымуляцыя глыбінных структур мозга электрычнымі імпульсамі вызнавалася за магчымы метад лячэння захворвання[16].
Эпідэміялогія[правіць | правіць зыходнік]
Хвароба Паркінсона складае 70—80 % выпадкаў сіндрому паркінсанізму. Яна з'яўляецца найчасцейшым нейрадэгенератыўным захворваннем пасля хваробы Альцгеймера[17][18]. Захворванне сустракаецца паўсюдна. Яго частасць хістаецца ад 60 да 140 людзей на 100 тысяч насельніцтва, лік хворых значна павялічваецца сярод прадстаўнікоў старэйшай узроставай групы. Удзельная вага людзей з хваробай Паркінсона ва ўзроставай групе старэй за 60 гадоў складае 1 %[19], а старэй за 85 гадоў — ад 2,6 % да 4 %[17]. Найчасцей першыя сімптомы захворвання з'яўляюцца ў 55-60 гадоў. Аднак у шэрагу выпадкаў хвароба можа развівацца і ва ўзросце да 40 (хвароба Паркінсона з раннім пачаткам) або да 20 гадоў (ювенільная форма захворвання).
Мужчыны хварэюць крыху часцей за жанчын. Значных расавых адрозненняў у эпідэмічнай структуры не выяўлена.
Этыялогія[правіць | правіць зыходнік]
Этыялогія хваробы Паркінсона станам на другую палову 2011 года канчаткова не высветлена. Этыялагічнымі фактарамі рызыкі прынята лічыць старэнне, генетычную схільнасць, уздзеянне фактараў навакольнага асяроддзя. Патамарфалагічна нармальнае старэнне суправаджаецца змяншэннем колькасці нейронаў чорнай субстанцыі і наяўнасцю ў іх цельцаў Леві. Старэнню таксама спадарожнічаюць нейрахімічныя змены ў паласатым целе — зніжэнне ўзроўню дафаміну і ферменту тыразінгідраксілазы, а таксама памяншэнне колькасці дафамінавых рэцэптараў. З дапамогай пазітронна-эмісійнай тамаграфіі даказана, што тэмпы дэгенерацыі нейронаў чорнай субстанцыі пры хваробе Паркінсона значна вышэйшыя, чым пры нармальным старэнні.
Каля 15 % людзей з хваробаю Паркінсона маюць сямейны анамнез дадзенага захворвання. Аднак гены, адказныя за развіццё хваробы Паркінсона, не ідэнтыфікаваныя[20].
Прычынамі паркінсонападобных праяўленняў могуць таксама быць уздзеянні фактараў навакольнага асяроддзя (пестыцыды, гербіцыды, солі цяжкіх металаў)[21], хранічная цэрэбраваскулярная недастатковасць або ўжыванне лекаў, якія выклікаюць экстрапірамідныя пабочныя эфекты[22].
Экалагічныя фактары[правіць | правіць зыходнік]
Высветлена, што пасля ін'екцыі рэчыва 1-метыл-4-феніл-1,2,3,6-тэтрагідрапірыдзін (МФТП) развіваецца паркінсанізм. МФТП пранікае скрозь ГЭБ і пад дзеяннем МАА-B акісляецца да 1-метыл-4-фенілпірыдзіну (МФП+). МФП+ пранікае ў мітахондрыі і інгібіруе комплекс I дыхальнага ланцуга. Падабенства хімічнай будовы МФТП і некаторых пестыцыдаў (напрыклад, ратэнон, паракват) і гербіцыдаў (напрыклад, Агент Оранж) дазволіла зрабіць здагадку, што МФТП-падобныя таксіны навакольнага асяроддзя спрыяюць развіццю хваробы Паркінсона[23][24][25]. Да фактараў рызыкі таксама адносяцца пражыванне на сяле і блізкасць прамысловых прадпрыемстваў і кар'ераў[25].
Рызыка развіцця хваробы Паркінсона ў курцоў у 3 разы ніжэй за некурцоў[23]. Мяркуюць, што гэта звязана з дафамін-стымулюючым эфектам нікаціну[23]. Акрамя таго, гэта можна растлумачыць наяўнасцю ў тытунёвым дыме злучэнняў, дзеянне каторых падобна да інгібітараў МАА[26]. Ад развіцця хваробы Паркінсона бароніць таксама ўжыванне кафеіну[27].
Акісляльная гіпотэза[правіць | правіць зыходнік]
Акісляльная гіпотэза робіць здагадку, што свабодныя радыкалы, якія ўтвараюцца пры акісляльным метабалізме дафаміну, іграюць важную ролю ў развіцці і прагрэсіраванні хваробы Паркінсона. Наяўнасць рэчываў, якія могуць служыць донарамі электронаў, у чорным рэчыве павялічваецца, што спрыяе ўтварэнню свабодных радыкалаў[20]. Акрамя таго, пры акісленні дафаміну пад уздзеяннем МАА ўтвараецца пераксід вадароду. Калі пераксід вадароду не звязваецца з глутатыёнам, то адбываецца накапленне вельмі рэактыўных гідраксільных радыкалаў, каторыя ўступаюць у рэакцыю з ліпідамі клетачных мембран, выклікаючы такім чынам перакіснае акісленне ліпідаў і гібель клетак.
Патагенез[правіць | правіць зыходнік]
Паталагічная анатомія[правіць | правіць зыходнік]


Пры хваробе Паркінсона пашкоджваюцца структуры экстрапіраміднай сістэмы — базальныя ядры і чорнае рэчыва, блакітная пляма і іншыя. Найбольш яскравыя змены назіраюцца ў пярэдніх аддзелах чорнай субстанцыі. Характэрныя для хваробы Паркінсона сімптомы ўзнікаюць пры гібелі 60-80 % нейронаў гэтага анатамічнага ўтварэння[28][29].
Макраскапічныя змены характарызуюцца дэпігментацыяй абсягаў чорнага рэчыва і блакітнай плямы, якія змяшчаюць меланін[17][30]. Пры мікраскапічным даследаванні пашкоджаных абсягаў выяўляюць змяншэнне колькасці нервовых клетак. У іх назіраецца наяўнасць цельцаў Леві. Таксама адбываецца гібель астрацытаў (разнастайнасці гліяльных клетак) і актывацыя мікрагліі. Цельцы Леві ўтвараюцца ў выніку збірання ў цытаплазме бялку α-сінуклеіну[28]. Наяўнасць цельцаў Леві — адна з прыкмет хваробы Паркінсона[30].
Цельцы Леві знаходзяць таксама і пры іншых нейрадэгенератыўных захворваннях. У сувязі з гэтым яны не лічацца спецыфічным маркерам хваробы Паркінсона. Акрамя таго, пры дадзеным захворванні ў чорнай субстанцыі і блакітнай пляме выяўлены «бледныя цельцы» — унутрыклетачныя гранулярныя ўключэнні, каторыя замяшчаюць меланін, які распадаецца[20].
У адпаведнасці з прапанаванай Браакам і суаўтарамі класіфікацыі, у асімптаматычнай стадыі хваробы Паркінсона цельцы Леві з'яўляюцца ў нервовых клетках нюхавай цыбуліны, прадаўгаватага мозга і вароліевага моста. З прэгрэсіраваннем захворвання наяўнасць дадзеных паталагічных цельцаў адзначаецца ў нейронах чорнай субстанцыі, сярэдняга мозга, базальных гангліяў і на канчатковых этапах у клетках кары галаўнога мозга[29].
Паталагічная фізіялогія[правіць | правіць зыходнік]
Шчыльная ўзаемасувязь паміж кампанентамі экстрапіраміднай сістэмы — палідумам і стрыятумам — забяспечваецца шматлікімі пучкамі нервовых валокнаў. Дзякуючы сувязям між таламусам і стрыяпалідарнай сістэмай утвараюцца рэфлектарныя дугі, якія забяспечваюць выкананне шматлікіх стэрэатыпных і аўтаматызаваных рухаў (напрыклад, хада, бег, плаванне, язда на ровары і інш.). Шчыльная сувязь стрыяпалідарнай сістэмы з ядрамі гіпаталамуса вызначае яе ролю ў механізмах эмацыйных рэакцый[31].
У норме экстрапірамідная сістэма пасылае імпульсы да перыферычных рухальных нейронаў. Гэтыя сігналы граюць важную ролю ў забеспячэнні міястатыкі шляхам гатоўнасці цягліц да адвольных рухаў. Ад дзейнасці дадзенага аддзела цэнтральнай нервовай сістэмы залежыць здольнасць чалавека да прымання аптымальнай для запланаванага дзеяння позы, дасягаюцца неабходныя суадносіны тонусу цягліц-аганістаў і цягліц-антаганістаў, а таксама плаўнасць і суразмернасць адвольных рухаў у часе і прасторы[31].
Характар клінічных праяў хваробы залежыць ад таго, якая частка стрыяпалідарнай сістэмы пашкоджана — стрыятум ці палідум. Калі празмерны тармазны ўплыў стрыятума, узнікае гіпакінезія — бедната рухаў, амімія. Гіпафункцыя стрыятума вядзе да ўзнікнення лішкавых міжвольных рухаў — гіперкінезаў[31]. Палідум аказвае тармазное ўздзеянне на структуры стрыятума. Для хваробы Паркінсона характэрна зніжэнне тармазнога уплыву палідума на стрыятум. Пашкоджанне палідума вядзе да «тармажэння тармажэння» перыферычных рухальных нейронаў[32].
Адкрыццё ролі нейрамедыятараў дазволіла растлумачыць функцыі экстрапіраміднай сістэмы, а таксама прычыны ўзнікнення клінічных праяў хваробы Паркінсона і паркінсанізму. У мозгу існуе некалькі дафамінергічных сістэм. Адна з іх пачынаецца ў нейронах чорнай субстанцыі, аксоны якіх праз ножку мозга, унутраную капсулу, бледны шар даходзяць да паласатага цела (лац.: corpus striatum). Тэрмінальныя аддзелы гэтых аксонаў утрымліваюць вялікую колькасць дафаміну і яго вытворных. Дэгенерацыя дадзенага ніграстрыярнага дафамінергічнага тракту з'яўляецца асноўным чыннікам развіцця хваробы Паркінсона. Другая ўзыходзячая дафамінергічная сістэма — мезалімбічны тракт. Ён пачынаецца ад клетак інтэрпедункулярнага ядра сярэдняга мозга і скончваецца ў гіпаталамусе і лобных долях галаўнога мозга. Гэты тракт бярэ ўдзел у кантролі настрою, паводзін і кантралюе пачатак рухальнага акта і рухаў афектыўнай рэакцыі (рухаў, каторыя суправаджаюць эмоцыі)[32].
Аснову ўсіх формаў паркінсанізму складае рэзкае змяншэнне колькасці дафаміну ў чорнай субстанцыі і паласатым целе[20] і адпаведна парушэнне функцыянавання дафамінергічных праводных трактаў галаўнога мозга.
Даследаванні на жывёлах[правіць | правіць зыходнік]
Для вывучэння этыялогіі і патагенезу хваробы Паркінсона, а таксама для распрацоўкі новых метадаў лячэння шырока выкарыстоўваюцца «мадэлі» дадзенай хваробы, якую выклікаюць у жывёл. У якасці мадэльных жывёл звычайна выкарыстоўваюцца генетычна мадыфікаваныя лініі мышэй [1] Архівавана 31 кастрычніка 2014.[33] і малпы — макакі-рэзусы [2] Архівавана 25 красавіка 2014.[34] і мармазеткі[35]. У малпаў сімптомы хваробы звычайна выклікаюць з дапамогай 1-метыл-4-феніл-1,2,3,6-тэтрагідрапірыдыну (MPTP) або 6-гідроксідапаміну (6-OHDA). Былі таксама атрыманы трансгенныя малпы з выбіральнай звышэкспрэсіяй у мозгу α-сінуклеіну, што выклікала развіццё сімптомаў хваробы Паркінсона.
Клінічная карціна[правіць | правіць зыходнік]
Для хваробы Паркінсона характэрныя 4 рухальныя разлады:
А таксама вегетатыўныя і псіхічныя разлады.
Трэмар (дрыжанне) — найбольш відавочны і лёгка вызначальны сімптом[36]. Для паркінсанізму характэрны трэмар спакою, хаця зрэдку могуць назірацца і іншыя тыпы трэмару (пастуральны, інтэнцыйны). Яго частасць — 4-6 Гц (рухаў за секунду). Ён звычайна пачынаецца ў дыстальным аддзеле адной рукі, пры прагрэсіраванні захворвання распаўсюджваецца на супрацьлеглую руку і на ногі[20]. Рознанакіраваныя рухі вялікага і іншых пальцаў знешне нагадваюць падлік манет або скручвавнне пілюль (падабенства з ручной тэхнікай стварэння пілюль у фарматэўтыцы)[37][38]. Калі-нікалі адзначаецца і дрыжанне галавы па тыпе «так-так» або «не-не», дрыжанне павекаў, языка, ніжняй сківіцы. У рэдкіх выпадках яно ахоплівае ўсё цела. Трэмар узмацняецца пры хваляванні і сціхае падчас сну і адвольных рухаў[39]. У адрозненні ад мазжачковага трэмару, каторы з'яўляецца падчас руху і адсутнічае ў спакоі, пры хваробе Паркінсона тыповая яго наяўнасць у спакоі і памяншэнне або знікненне пры рухах[40].

Гіпакінезія — зніжэнне спантаннай рухальнай актыўнасці. Хворы можа застываць, гадзінамі захоўваючы нерухомасць. Характэрна агульная скаванасць. Актыўныя рухі ўзнікаюць пасля некаторай затрымкі, тэмп іх запаволены — брадыкінезія[40]. Хворы ходзіць дробнымі крокамі, ступні пры гэтым размяшчаюцца паралельна адна адной — лялечная хада[39]. Твар маскападобны (амімія), позірк застылы, мірганні рэдкія. Усмешка, грымаса плачу ўзнікаюць з запазненнем і гэтак жа павольна знікаюць[40].

Маўленне пазбаўленае выразнасці, аднастайнае і мае тэндэнцыю да затухання. У выніку характэрнага для хваробы Паркінсона змяншэння амплітуды рухаў почырк становіцца дробным — мікраграфія[38][39].
Адной з праяў алігакінезіі (памяншэнне колькасці рухаў) з'яўляецца адсутнасць фізіялагічных сінкінезій (садружных рухаў). Падчас хады рукі не здзяйсняюць звычайных размашыстых рухаў, яны застаюццы прыціснутымі да тулава (ахейракінез). Калі хворы глядзіць угору, адсутнічае звычайнае наморшчванне лба. Сцісканне пальцаў у кулак не суправаджаецца разгінаннем кісці. Хворы не можа выконваць некалькі мэтанакіраваных рухаў адначасова. Усе дзеі нагадваюць аўтаматычныя[38][39][40].
Цягліцавая рыгіднасць — раўнамернае павышэнне тонусу цягліц па пластычным тыпе. Канцавіны пры іх згінанні і разгінанні застываюць у нададзеным ім стане. Такая форма павышэння цягліцавага тонусу называецца «пластычнай васкавой гнуткасцю». Пераважанне рыгіднасці ў пэўных групах цягліц вядзе да фарміравання характэрнай позы просьбіта[38] (таксама вядомая як «поза манекена»[39][40]): хворы гарбаціцца, галава нахіляецца ўперад, паўсагнутыя ў локцевых суставах рукі прыціснутыя да цела, ногі таксама крыху сагнутыя ў лагвова-сцегнавых і каленевых суставах. Пры пасіўным згінанні-разгінанні перадплечча, галавы, кругавых рухах у прамянёва-запясцевым суставе можна адчуць своеасаблівую перарывістасць, ступеньчатасць напружвання цягліц — «сімптом зубчастага кола»[38][40].
Змены цягліцавага тонусу вядуць да парушэння тэндэнцыі канцавіны да вяртання ў зыходную пазіцыю пасля здзейсненага руху. Напрыклад, пасля рэзкага пасіўнага тыльнага згінання ступні яна некаторы час захоўвае нададзеную ёй пазіцыю — феномен Вестфаля[39].
Пастуральная няўстойлівасць развіваецца на позніх стадыях захворвання[20]. У хворага адзначаюцца цяжкасці пераадолення як інерцыі спакою, гэтак і інерцыі руху. Хвораму цяжка пачаць рух, а, пачаўшы яго, цяжка спыніцца. Узнікаюць з'явы прапульсіі (лац.: propulsio — праштурхванне наперад), латэрапульсіі і рэтрапульсіі. Яны выяўляюцца ў тым, што, пачаўшы рух наперад, убок або назад, тулава звычайна як бы абганяе ногі, у выніку чаго парушаецца пастава цэнтра цяжару. Чалавек губляе ўстойлівасць і падае долу[39]. Калі-нікалі ў хворых выяўляюць «парадаксальныя кінезіі», калі ў выніку эмацыйных перажыванняў, пасля сну альбо праз уздзеянне іншых фактараў чалавек пачынае свабодна перасоўвацца, знікаюць характэрныя для захворвання сімптомы. Праз некалькі гадзін сімптаматыка вяртаецца[38].
Вегетатыўныя і псіхічныя разлады. Акрамя парушэнняў рухальнай сферы, пры хваробе Паркінсона адзначаюцца вегетатыўныя разлады, а таксама парушэнні абмену рэчываў. Наступствам можа быць альбо знясіленне (кахексія), альбо атлусценне. Сакраторныя разлады праяўляюцца сальнасцю скуравага покрыва, асабліва твару, павышаным слінавыдзяленнем, лішкавай патлівасцю[38][39].
Псіхічныя разлады пры хваробе Паркінсона могуць быць абумоўлены як самім захворваннем, гэтак і антыпаркінсанічнымі прэпаратамі. Пачатковыя прыкметы псіхозу (страх, разгубленасць, бессань, галюцынаторна-параноідны стан з парушэннем арыенціроўкі) адзначаюць у 20 % амбулаторных і дзвюх трацін хворых з цяжкай формай паркінсанізму. Недаўсціп выяўляецца слабей, чым пры сенільнай дэменцыі. У 47 % назіраюць дэпрэсію, у 40 % — разлады сну і паталагічную зморлівасць[41]. Хворыя безыніцыятыўныя, вялыя, а таксама назойлівыя, схільныя да паўтарэння адных і тых жа пытанняў[38][39].
Выдзяляюць некалькі клінічных формаў захворвання — рыгідна-брадыкінетычную, дрыжальна-рыгідную і дрыжальную[42]:
- Рыгідна-брадыкінетычная форма характарызуецца павышэннем тонусу цягліц па пластычным тыпе, прагрэсіруючым запавольваннем актыўных рухаў ажно да поўнай згубы магчымасці рухацца. З'яўляюцца цягліцавыя кантрактуры. Характэрна «поза манекена» («поза просьбіта»).
- Дрыжальна-рыгідная форма характарызуецца трэмарам канцавін, пераважна іх дыстальных аддзелаў, да якога далучаецца скаванасць адвольных рухаў.
- Для дрыжальнай формы характэрна наяўнасць пастаяннага або амаль пастаяннага сярэдне- і буйнаамплітуднага трэмару канцавін, языка, галавы, ніжняй сківіцы. Тонус цягліц нармальны або крыху павышаны. Тэмп адвольных рухаў захаваны.
Дыягностыка і дыферэнцыяльны дыягназ. Іншыя віды паркінсанізму[правіць | правіць зыходнік]
Дыягностыка хваробы Паркінсона ў большасці выпадкаў не выклікае ніякіх цяжкасцей — дастаткова наяўнасці ў пацыента гіпакінезіі і аднаго з сімптомаў: трэмару спакою, рыгіднасці, пастуральных парушэнняў у спалучэнні са станоўчым эфектам ад прыняцця левадопы[36]. На пачатковых этапах захворвання, калі праявы захворвання не праяўляюцца або праяўляюцца слаба, правільнай дыягностыцы можа спрыяць выяўленне пастуральных рэфлексаў (рэфлексаў паставы). Да іх адносіцца апісаны вышэй феномен Вестфаля, а таксама феномен Фуа—Тэвенара (альбо феномен галёнкі). Дадзеныя рэфлексы ўзнікаюць у выніку павышэння пластычнага тонусу цягліц. Феномен галёнкі праяўляецца тым, што максімальна сагнутая ў каленевым суставе нага хворага, каторы ляжыць на жываце, апускаецца павольна і звычайна разгінаецца не цалкам[39].
Дыферэнцыяльны дыягназ хваробы Паркінсона з іншымі паталогіямі адбываецца ў два этапы. Варта выключыць станы і працэсы, пры каторых маюцца падобныя да паркінсанізму сімптомы. Пры наяўнасці ў хворага паркінсанізму неабходна ўлічваць, што дадзены сімптом характэрны для шэрага захворванняў.
Патагнаманічныя для паркінсанізму сімптомы назіраюцца пры наступных разладах[20]:
- псіхаматорная заторможенность — дэпрэсія, кататанічны ступар, істэрыя, гіперсамнія;
- цягліцавы гіпертонус — нейраміятанія, сіндром «рыгіднага чалавека»;
- апраксія хады — норматэнзіўная гідрацэфалія, пухліны мозга і інш.;
- трэмар — пашкоджванне мазжачка.
Паркінсанізм таксама можа быць выкліканы цэлым шэрагам захворванняў. У большасці выпадкаў (~80 %) ён выкліканы пашкоджаннем ніграстрыярнай сістэмы праз хваробу Паркінсона. Пры пашкоджаннях адпаведных аддзелаў цэнтральнай нервовай сістэмы іншай этыялогіі будуць узнікаць таксічны, лекавы, постэнцэфалітычны, судзінавы, посттраўматычны і іншыя паркінсанізмы[20].
Пры многіх захворваннях развіваецца сіндром паркінсанізму ў спалучэнні з сімптомамі пашкоджання іншых аддзелаў цэнтральнай нервовай сістэмы. Для пазначэння дадзенай групы захворвання выкарыстоўваюць тэрмін «паркінсон-плюс»[20].
| Тып | Форма | Частасць, % |
|---|---|---|
| Першасны (ідыяпатычны) паркінсанізм | Хвароба Паркінсона | 80,2 |
| Ювенільны паркінсанізм | * | |
| Другасны паркінсанізм | Постэнцэфалітычны | 0,5 |
| Лекавы | 3,9 | |
| Судзінавы | 2,1 | |
| Таксічны | * | |
| Траўматычны | * | |
| Паркінсанізм, звязаны з тырэоіднымі парушэннямі, гіпатырэаідызмам, гепатацэрэбральнай дэгенерацыяй, пухлінай мозга, гідрацэфаліяй, сірынгамезэнцэфаліяй | * | |
| Паркінсанічны сіндром пры мультысістэмнай дэгенерацыі — «паркінсанізм-плюс» |
Прагрэсіруючы супрануклеярны параліч (сіндром Стыла-Рычардсана) | 7,4 |
| Сіндром Шая-Драйжэра | 1,7 | |
| Стрыята-нігральная дэгенерацыя | 0,4 | |
| Комплекс паркінсанізм-дэменцыя-бакавы аміятрафічны склероз | 0,2 | |
| Кортыка-базальная дэгенерацыя | 0,5 | |
| Хвароба дыфузных цельцаў Леві | 1,2 | |
| Хвароба Галервордэна-Шварца | 0,3 | |
| Аліва-понта-цэрэбральная дэгенерацыя | * |
* Формы паркінсанізму, частасць сустракання каторых не падаецца, дыягнастуюць рэдка, і агулам яны складаюць не больш за 2,2 %.
У адпаведнасці з апошнімі пагадненнямі Еўрапейскай асацыяцыі хваробы Паркінсона[43] сіндром паркінсанізму падраздзяляюцца на чатыры групы:
- ідыяпатычны паркінсанізм;
- генетычныя формы паркінсанізму, сямейны сіндром паркінсанізму — спадчынная форма, пазначаецца лакалізацыяй гена (напрыклад, PARK1);
- паркінсанізм у межах іншых нейрадэгенератыўных захворванняў (атыповыя формы паркінсанізму, якія калі-нікалі называюцца з прычыны дадатковых сімптомаў «сіндром паркінсанізм плюс»);
- сімптаматычныя сіндромы Паркінсона — напрыклад, як наступства некаторых медыкаментаў, амфетамінаў, траўмаў, пухлін, дзеяння таксічных рэчываў, эндакрынна-метабалічных парушэнняў, запаленча-інфекцыйных захворванняў.
Ідыяпатычны і атыповы паркінсанізм могуць у якасці праяўленняў нейрадэгенератыўных захворванняў класіфікавацца як сінуклеінпатыі (ідыяпатычны паркінсанізм, мультысістэмная атрафія, дэменцыя з цельцамі Леві) або таупатыі (прогрэсіруючы супрануклеярны парэз позірку, кортыка-базальная дэменцыя).
У 1992 годзе брытанскі ўрач Х’юз прапанаваў крытэрыі дыягностыкі хваробы Паркінсона, якія дазваляюць паставіць дыягназ з дакладнасцю да 93 % (згодна дадзеным аўтапсій)[44]:
- Наяўнасць гіпакінезіі і прынамсі аднаго з наступных сімптомаў: рыгіднасць, трэмар спакою 4-6 Гц, пастуральныя парушэнні.
- Асіметрычны дэбют захворвання (стадыя геміпаркінсанізму).
- Прагрэсіруючае цячэнне.
- Адсутнасць у анамнезе магчымых этыялагічных фактараў другаснага паркінсанізму (прыём нейралептыкаў, верагодна перанесены энцэфаліт, вострыя парушэнні мазгавога кровазвароту, паўторныя або цяжкія чэрапна-мазгавыя траўмы).
- Адсутнасць наступных сімптомаў:
- a) на ўсіх стадыях захворвання:
- яскравай мазжачковай і/або піраміднай сімптаматыкі;
- над'ядравага паралічу позірку;
- акулагірных крызаў;
- b) на ранніх стадыях захворвання:
- грубых пастуральных разладаў;
- грубай прагрэсіруючай вегетатыўнай недастатковасці;
- грубай дэменцыі.
Гэтыя крытэрыі павінны выконвацца толькі пры адборы хворых для навуковых даследаванняў. Для папярэдняга дыягназу дастатковае выконванне толькі двух першых пунктаў[36].
Стадыі паркінсанізму па Хён і Яру (Hoehn, Yahr, 1967 г.)[правіць | правіць зыходнік]
Найчасцей у медыцыне карыстаюцца класіфікацыяй стадый паркінсанізму па Хён і Яру[45] [46]. Упершыню яна была апублікаваная ў 1967 годзе ў часопісе Neurology Маргарэт Хён (англ.: Hoehn) і Мелвінам Ярам (англ.: Yahr). Першапачаткова яна апісвала 5 стадый прагрэсіравання хваробы Паркінсона (1-5)[47]. Затым шкалу мадыфікавалі, дапоўніўшы яе стадыямі 0, 1,5 і 2,5[48].
- Стадыя 0 — няма прыкмет захворвання.
- Стадыя 1 — сімптомы праяўляюцца на адной з канцавін.
- Стадыя 1,5 — сімптаматыка праяўляецца на адной з канцавін і тулаве.
- Стадыя 2 — двухбаковыя праявы без пастуральнай няўстойлівасці.
- Стадыя 2,5 — двухбаковыя праявы з пастуральнай няўстойлівасцю. Хворы здольны пераадольваць інерцыю руху, выкліканую штуршком.
- Стадыя 3 — двухбаковыя праявы. Пастуральная няўстойлівасць. Хворы здольны да самаабслугоўвання.
- Стадыя 4 — рэзкае зніжэнне магчымасці рухацца, патрэбнасць у старонняй дапамозе. Пры гэтым хворы здольны хадзіць і/або стаяць без падтрымкі.
- Стадыя 5 — хворы прыкаваны да фатэля ці ложка. Цяжкая інвалідызацыя.
Лячэнне[правіць | правіць зыходнік]

Кансерватыўнае лячэнне[правіць | правіць зыходнік]
У цяперашні час хвароба Паркінсона з’яўляецца невылечнай, усе існуючыя метады лячэння скіраваныя на палягчэнне яе сімптомаў (сімптаматычнае лячэнне). Асноўныя прэпараты, якія памяншаюць ці ліквідуюць рухальныя парушэнні: левадопа (часцей у камбінацыі з перыферычнымі інгібітарамі ДОФА-дэкарбаксілазы або радзей з інгібітарамі КОМТ), аганісты дафамінавых рэцэптараў і інгібітары МАА-Б[5].
Дафамінергічныя прэпараты[правіць | правіць зыходнік]
Дыоксіфенілаланін (скарочана допа, або дофа) — біягеннае рэчыва, каторае ўтвараецца ў арганізме з тыразіну і з’яўляецца папярэднікам дафаміну, які, у сваю чаргу, з’яўляецца папярэднікам норадрэналіну. У сувязі з тым, што пры хваробе Паркінсона колькасць дафаміну ў галаўным мозгу значна зніжана, для лячэння захворвання мэтазгодна ўжыванне рэчываў, якія павышаюць яго ўзровень у ЦНС. Сам дафамін не можа быць выкарыстаны для гэтай мэты, бо ён блага пранікае скрозь гемата-энцэфалічны бар'ер[49].
Левадопа[правіць | правіць зыходнік]

У якасці лекаў шырока ўжываюць сінтэтычны левакруцячы ізамер дыоксіфенілаланіну (скарочана L-дофа), які значна больш актыўны за правакруцячы. Левадопа добра ўсмоктваецца пры прыёме унутр. Большая частка прэпарата трапляе ў печань і ператвараецца ў дафамін, які не пранікае скрозь гемата-энцэфалічны бар’ер. Для змяншэння дэкарбаксіліравання прэпарат рэкамендуюць прымаць разам з інгібітарамі дофа-дэкарбаксілазы (бенсеразідам, карбідопай)[49].
Прэпарат эфектыўны пры хваробе Паркінсона і паркінсанізму. Ён памяншае гіпакінезію і рыгіднасць. Пры трэмару, дысфагіі і слінацячэнні лячэбны эфект дасягаецца ў 50-60 %[49] выпадкаў .
Прэпарат можна прызначаць з цэнтральнымі халінаблакатарамі і не варта прымяняць з незваротнымі інгібітарамі монаамінаксідазы (МАА)[49].
Пры ўжыванні магчымыя пабочныя эфекты: дыспепсічныя з’явы (нудзь, ваніты, страта апетыту), гіпатэнзія, арытміі, гіперкінезы і інш.[49]
У пацыентаў маладзей 60-70 гадоў прызначэнне левадопы праз развіццё пабочных эфектаў і зніжэнне эфектыўнасці пры працяглай тэрапіі стараюцца адкласці і ўжываюць іншыя лекавыя сродкі[50]. Лячэнне пацыентаў старэй за 70 гадоў нават у пачатковых стадыях рэкамендуюць пачынаць з левадопы, што тлумачаць меншай эфектыўнасцю прэпаратаў іншых груп і больш частымі саматычнымі і псіхічнымі пабочнымі эфектамі ў гэтым узросце.
Аганісты дафаміну[правіць | правіць зыходнік]
У якасці асноўнага лячэння ўжываюць таксама аганісты дафамінавых рэцэптараў (бромакрыпцін, пергалід, праміпексол, кабергалін, апамарфін, лізурыд). Прэпараты дадзенай групы з’яўляюцца спецыфічнымі цэнтральнымі аганістамі дафамінавых рэцэптараў. Імітуючы дзеянне дафаміну, яны выклікаюць тыя ж фармакалагічныя эфекты, што і левадопа[51].
У параўнанні з левадопай яны радзей выклікаюць дыскінезіі і іншыя рухальныя разлады, але часцей аказваюць іншыя пабочныя эфекты: ацёкі, аспаласць, запоры, заварот галавы, амарокі, нудзь[52].
Інгібітары МАА тыпу Б і катэхол-О-метылтрансферазы[правіць | правіць зыходнік]
Дадзеная група прэпаратаў выбіральна памяншае актыўнасць ферментаў, якія расшчапляюць дафамін: монаамінаксідаза (МАА тыпу Б) і катэхол-О-метылтрансфераза (КОМТ). інгібітары МАА-Б (напрыклад, селегілін, разагілін) і інгібітары КОМТ (напрыклад, энтакапон і талкапон) запавольваюць няўхільнае прагрэсіраванне хваробы Паркінсона. Фармакалагічныя эфекты аналагічныя левадопе, хаця іх выказанасць значна менш. Яны дазваляюць узмацніць эфекты левадопы, не павялічваючы і нават зніжаючы яе сумарную дозу[28][53].
Інгібітары зваротнага нейранальнага захопу дафаміну[правіць | правіць зыходнік]

Непрамыя дафамінаміметыкі (амантадын, глудантан) павышаюць адчувальнасць рэцэптараў да адпаведнага медыятара. Дадзеныя прэпараты ўзмацняюць выдзяленне дафаміну з перадсінаптычных канчаткаў і запавольваюць яго зваротны нейранальны захоп. Лекавыя сродкі дадзенай групы выклікаюць тыя жа фармакалагічныя эфекты, што і левадопа, гэта значыць яны пераважна падаўляюць гіпакінезію і цягліцавую рыгіднасць, значна меней уплываючы на трэмар[51].
Цэнтральныя халінаблакатары[правіць | правіць зыходнік]
Для лячэння паркінсанізму ўжываюць антыхалінергічныя сродкі. Знакаміты французскі ўрач Жан Мартэн Шарко яшчэ ў 1874 годзе выкарыстоўваў беладонну для змяншэння назіральнай пры захворванні ўзмоцненай салівацыі. Ім таксама было адзначана змяншэнне трэмару падчас яе прыёму. У далейшым для лячэння сталі выкарыстоўваць не толькі прэпараты беладонны, але і іншыя халінаблакатары — атрапін і скопаламін. Пасля з’яўлення сінтэтычных халіналітыкаў сталі ўжывацца трыгексіфенідыл (цыкладол), трыперыдэн, біперыдэн, трапацын, этпенал, дыдэпіл і дынезін[54].
Ужыванне халінаблакатараў патагенетычна абгрунтаванае. Пашкоджанне чорнай субстанцыі і іншых нервовых утварэнняў прыводзіць да істотных зрухаў у халін- і дафамінергічных працэсах, а менавіта да павышэння халінергічнай актыўнасці і паніжэння дафамінергічнай. Такім чынам цэнтральныя халінаблакатары «выраўніваюць» нейрамедыятарныя ўзаемадзеянні[54].
Прэпараты беладонны, якія ўжываліся раней, дзейнічаюць пераважна на перыферычныя ацэтылхалінавыя рэцэптары і меней — на халінарэцэптары мозга. У сувязі з гэтым тэрапеўтычнае дзеянне дадзеных прэпаратаў адносна малое. Разам з тым яны выклікаюць шэраг пабочных з’яў: сухасць у роце, парушэнне акамадацыі, затрымку мачы, агульную слабасць, заварот галавы і іншыя[54].
Сучасныя сінтэтычныя супрацьпаркінсанічныя цэнтральныя халінаблакатары характаразуюцца больш выбіральным дзеяннем. Яны шырока ўжываюцца падчас лячэння экстрапірамідных захворванняў, а таксама неўралагічных ускладненняў, якія выклікаюцца нейралептыкамі[54].
Выбітнай уласцівасцю цэнтральных халінаблакатараў з’яўляецца тое, што яны ў большай ступені ўздзейнічаюць на трэмар; у меншай ступені ўплываюць на рыгіднасць і брадыкінезію. У сувязі з перыферычным дзеяннем змяншаецца слінацячэнне, у меншай ступені потавыдзяленне і сальнасць скуры[54].
Хірургічнае лячэнне[правіць | правіць зыходнік]
Хірургічныя метады лячэння можна падзяліць на два тыпы: дэструкцыйныя аперацыі і стымуляцыю глыбінных мазгавых структур.
Дэструкцыйныя аперацыі[правіць | правіць зыходнік]
Да дэструкцыйных аперацый, якія праводзяць пры хваробе Паркінсона, адносяцца талама- і палідатамія.
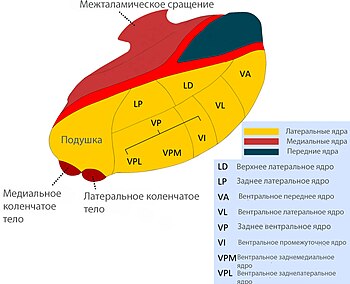
Таламатамія паказана толькі ў тых выпадках, калі асноўным сімптомам захворвання з’яўляецца трэмар[55]. Для атрымання станоўчага выніку ад аперацыі хворыя павінны адпавядаць некалькім крытэрыям: хвароба Паркінсона выяўляецца аднабаковым трэмарам, кансерватыўнае лячэнне неэфектыўнае[56][57]. Паказана, што разбурэнне вентральнага прамежкавага ядра таламуса (лац.: nucleus ventralis intermedius) вядзе да зніжэння трэмару ў хворых на паркінсанізм[58][59]. У адпаведнасці з літаратурнымі дадзенымі[56][60], эфектыўнасць аперацыі па знішчэнні трэмару пры хваробе Паркінсона дасягае 96 %. Пры гэтым тыя ж аўтары адзначаюць высокую рызыку ўскладненняў (13 % трывалых[60] і 56 % часовых[56]). Да ўскладненняў, якія ўзнікаюць пасля таламатаміі, адносяць дызартрыю, абулію, дысфазію, дыспраксію.
Палідатамія можа быць паказана хворым з пераважаннем рухальных разладаў, для якіх кансерватыўнае лячэнне неэфектыўнае. Працэдура зводзіцца да ўвядзення іглы ў бледны шар (лац.: globus pallidus) з наступным яго частковым разбурэннем.
Палідатамія з’яўляецца адносна бяспечнай працэдурай. Падчас аналізу 85 артыкулаў, прысвечаных палідатаміі, і адпаведна вынікаў лячэння 1510 хворых былі вылучаны такія ўскладненні дадзенай аперацыі[61]:
| Ускладненне | Колькасць хворых | Узровень (%) |
|---|---|---|
| Унутрычарапное кровазліццё | 26 | 1,7 % |
| Постаперацыйны псіхоз | 8 | 0,5 % |
| Гіперсалівацыя | 9 | 0,6 % |
| Сутаргавыя прыступы | 8 | 0,5 % |
| Парушэнне фанацыі | 20 | 1,3 % |
| Парушэнне палёў зроку | 30 | 2,0 % |
| Дэпрэсія | 13 | 0,9 % |
| Парушэнне функцыі тваравага нерва | 56 | 3,7 % |
| Дызартрыя | 18 | 1,2 % |
| Парушэнне памяці | 19 | 1,3 % |
| Слабасць у адной з канцавін | 24 | 1,6 % |
| Іншыя ўскладненні | 30 | 2,0 % |
Эфектыўнасць палідатаміі пры хваробе Паркінсона дастаткова высокая. Гіпакінезія ў супрацьлеглых боку аперацыі канцавінах зніжаецца ў 82 % выпадкаў[62].
З развіццём радыехірургіі з’явілася новая магчымасць ажыццяўляць разбурэнне адпаведных нервовых структур без траўматызацыі навакольных структур і тканак[63][64][65][66][67].
Нейрастымуляцыя[правіць | правіць зыходнік]

Нейрастымуляцыя з’яўляецца сучасным метадам лячэння, які ўяўляе сабой малаінвазіўную нейрахірургічную аперацыю.
Дадзены метад ужываецца ў наступных выпадках[68]:
- Нягледзячы на слушна падабраную лекавую тэрапію, у пацыента не атрымліваецца дасягнуць значнага змяншэння сімптомаў.
- Прагрэсіраванне захворвання вядзе да неабходнасці павялічваць дозы лекавых прэпаратаў, пры гэтым пабочныя эфекты лекаў становяцца нясцерпнымі.
- Пацыент сацыяльна актыўны і пужаецца страты працы праз сваё захворванне.
- Пацыент губляе здольнасць да самаабслугоўвання і становіцца залежным ад сваёй сям’і ў выкананні штодзённых дзей.
Сутнасць метада: лячэбны эфект дасягаецца за кошт стымуляцыі дакладна разлічаным невялікім па амплітудзе электрычным токам пэўных структур галаўнога мозга, адказных за кантроль над рухамі цела. Для гэтага пацыенту ўводзяцца ў галаўны мозг тонкія электроды, якія злучаюцца з нейрастымулятарам (падобны да кардыястымулятара), які імплантуецца падскурна ў абсягу грудзей пад ключыцаю[69].
Сама аперацыя звычайна праводзіцца ў два этапы. На першым этапе пад мясцовым абязбольваннем з дапамогай магнітна-рэзананснай тамаграфіі і стэрэатаксічнай нейранавігацыі электроды ўводзяцца ў глыбінныя структуры галаўнога мозга, адказныя за кантроль над рухамі — у абсяг субталамічнага ядра (STN). Потым ажыццяўляецца тэставая стымуляцыя, падчас якой пацыент паведамляе пра саматасенсорныя адчуванні, якія ўзнікаюць пры розных параметрах стымуляцыі. Пры станоўчым выніку праводзіцца другі этап: пацыенту імплантуюцца падскурныя часткі сістэмы — канектары і генератар імпульсаў (нейрастымулятар). Звычайна другі этап праводзіцца пад наркозам. У пасляаперацыйным перыядзе ажыццяўляецца праграмаванне нейрастымулятара і навучанне пацыента. Пацыент мае магчымасць сам карэкціраваць налады стымуляцыі (у межах, зададзеных урачом) у залежнасці ад уласнага самаадчування і асаблівасцей дзейнасці, якую выконвае хворы[69].
- Павялічваецца перыяд эфектыўнага кантролю над сімптомамі хваробы.
- Значна зніжаецца неабходнасць у антыпаркінсанічных леках.
- Дазваляе неінвазіўна карэкціраваць налады стымуляцыі пры прагрэсіраванні захворвання.
- У адрозненні ад палідатаміі і таламатаміі, з’яўляецца абарачальнай.
- Можа быць білатэральнай (гэта значыць эфектыўна і пры сімптомах з абодвух бакоў цела).
- Лёгка пераносіцца і з’яўляецца бяспечным метадам.
Лячэнне з ужываннем ствалавых клетак. Генная тэрапія[правіць | правіць зыходнік]
Вынікі першых выпрабаванняў па ўжыванні ствалавых клетак падчас хваробы Паркінсона былі апублікаваныя ў 2009 годзе. У адпаведнасці з атрыманымі дадзенымі, праз 36 месяцаў пасля ўвядзення ствалавых клетак станоўчы эфект адзначаны ў 80 % хворых[72]. Лячэнне заключаецца ў трансплантацыі нейронаў, атрыманых у выніку дыферэнцыроўкі ствалавых клетак, у галаўны мозг. Тэарэтычна яны павінны замяніць загінуўшыя дафамінсакрэтуючыя клеткі[73]. Метад па стане на другую палову 2011 года даследаваны недастаткова і не мае шырокага клінічнага ўжывання[74][75].
У 2003 годзе ўпершыню чалавеку з хваробай Паркінсона ў субталамічнае ядро былі ўведзеныя генетычныя вектары, якія змяшчалі ген, адказны за сінтэз глутаматдэкарбаксілазы. Дадзены фермент зніжае актыўнасць субталамічнага ядра. Вынікам гэтага з’яўляецца тое, што ён мае станоўчы тэрапеўтычны ўплыў. Нягледзячы на атрыманыя добрыя вынікі лячэння, станам на першую палову 2011 года методыка практычна не ўжываецца і знаходзіцца ў стадыі клінічных даследаванняў[76][77][78].
Прагноз[правіць | правіць зыходнік]

Прагноз умоўна неспрыяльны — хвароба Паркінсона няўхільна прагрэсіруе. Сімптомы парушэння рухаў развіваюцца найбольш хутка. Хворыя, якія не атрымліваюць лячэнне, у сярэднім губляюць магчымасць абслугоўваць сябе самастойна праз 8 гадоў ад пачатку захворвання, а праз 10 гадоў становяцца прыкаванымі да ложка[79]. Станам на другую палову 2011 года большасць пацыентаў атрымлівае адпаведнае лячэнне. Прагноз у дадзенай групе лепшы за групу хворых, якія не атрымліваюць адэкватнай тэрапіі. Асобы, якія прымаюць левадопу, становяцца залежнымі ад абслугоўваючых іх асоб у сярэднім праз 15 гадоў[79]. Тым не менш, у кожным канкрэтным выпадку хуткасць прагрэсіравання захворвання розная[79]. Адзначана, што пры адносна раннім развіцці хваробы Паркінсона найхутчэй прагрэсіруюць сімптомы парушэння рухальнай актыўнасці, а пры з’яўленні першых сімптомаў у асоб ад 70 гадоў і старэй на першы план выходзяць псіхічныя разлады[80].
Адэкватная тэрапія запавольвае развіццё шэрага сімптомаў, якія вядуць да страты працаздольнасці хворых (цягліцавай рыгіднасці, гіпакінезіі, пастуральнай няўстойлівасці і іншых). Аднак праз 10 гадоў ад моманту пачатка захворвання працаздольнасць большасці хворых значна зніжана[80][79].
Працягласць жыцця хворых зніжана[79]. Працаздольнасць у дадзеных хворых стойка і незваротна губляецца, у залежнасці ад выказанасці неўралагічных парушэнняў хворым прызначаецца група інваліднасці.
Рэабілітацыя[правіць | правіць зыходнік]
Ёсць доказы таго, што маўленчыя і рухальныя праблемы, ад якіх церпяць хворыя, можна палепшыць з дапамогай рэабілітацыі, зрэшты даследаванняў па гэтай тэме станам на 15 кастрычніка 2014 г. яшчэ бракуе, а якасць некаторых з іх выклікае пытанні[81][82]. Рэгулярныя фізічныя практыкаванні, якія выконваюцца ў межах або па-за межамі фізіятэрапіі, могуць прыносіць плён у выпраўленні і паляпшэнні мабільнасці, гнуткасці, моцы, хуткасці хады і якасці жыцця[82]. Аднак, калі праграма практыкаванняў выконваецца пад наглядам фізіятэрапеўта, ступень паляпшэння рухальных сімптомаў, ментальных і эмацыйных функцый, штодзённай жыццёвай актыўнасці і якасці жыцця значна большая ў параўнанні з праграмамі, якія пацыент самастойна выконвае дома[83]. Для паляпшэння гнуткасці і дыяпазону рухаў у людзей, якія маюць рыгіднасць, агульныя рэлаксацыйныя тэхнікі, як лёгкае трасенне хворага і асобных частак яго цела, былі прызнаныя эфектыўнымі, бо яны змяншаюць празмернае цягліцавае напружанне. Іншыя эфектыўныя тэхнікі, якія даюць расслабленне, уключаюць у сябе павольныя круцільныя рухі канечнасцей і тулава, рытмічныя рухі, дыяфрагмальнае дыханне і медытатыўныя тэхнікі[84]. Што тычыцца парушэнняў хады і іншых праяў гіпакінезіі, фізіятэрапеўты маюць разнастайныя стратэгіі па паляпшэнні функцыянальнай мабільнасці. Сферы навуковых інтарэсаў у пытаннях хады факусіруюцца (але не абмяжоўваюцца гэтым) на паляпшэнні найперш хуткасці хады, устойлівасці падчас яе, сінхранізацыі рухаў цела і рук. Стратэгіі ўключаюць ужыванне дадатковага абсталявання (хада з кіем і на бегавой дарожцы), славесную падтрымку пацыента (а таксама і ручную, зрокавую і слыхавую), практыкаванні (маршыраванне) і змены ўмоў хады (узроўняў паверхні; стварэнне або прыбіранне перашкод)[85]. Сілавыя практыкаванні паказалі паляпшэнне моцы і маторных функцый людзей, у якіх былі першасная цягліцавая слабасць або цягліцавая слабасць, выкліканая гіпадынаміяй праз мяккую або сярэднюю форму хваробы Паркінсона. Аднак справаздачы даследаванняў паказваюць наяўнасць сувязі таксама і паміж моццу і часам прыёму медыкаментаў, таму цяжка сказаць, што паляпшае стан пацыента ў гэтым выпадку: лекі ці практыкаванні. Зрэшты, з гэтай жа прычыны хворым рэкамендуецца выконваць практыкаванні ў перыяд часу паміж 45 хвілінамі і 1 гадзінай пасля прыёму лекаў, калі пацыенты знаходзяцца ў сваёй найлепшай фізічнай форме[86]. Даказана, што праз спецыфічную для хваробы позу (пацыент пастаянна сагнуты ўперад і ўніз) пацыенты пакутуюць ад хранічнай гіпаксіі, бо назіраецца рэспіраторная дысфункцыя, якую дапамагае паменшыць глыбокае дыяфрагмальнае дыханне[87]. Ёсць інфармацыя аб тым, што практыкаванні дапамагаюць змагацца з запорам.
Адным з найбольш шырока практыкуемых спосабаў лячэння маўленчых разладаў, асацыяваных з хваробай Паркінсона, з'яўляецца тэрапія Лі Сільвермэна (LSVT ад англ.: Lee Silverman voice treatment)[81][88]. Увогуле любая маўленчая тэрапія, але асабліва LSVT, дапамагае палепшыць маўленне[81]. Працатэрапія ставіць сваёй мэтай палепшыць здароўе і якасць жыцця хворых, ангажуючы іх удзельнічаць у такой колькасці штодзённай актыўнасці, наколькі гэта ўвогуле магчыма[81]. Зрэшты, станам на 15 кастрычніка 2014 г. былі апублікаваныя толькі некалькі навуковых прац на тэму даследавання эфектыўнасці працатэрапіі[81][89].
Сацыяльныя і культурныя аспекты хваробы Паркінсона[правіць | правіць зыходнік]
Эканамічныя аспекты[правіць | правіць зыходнік]

Кошты хваробы Паркінсона для грамадства высокія, але дакладны падлік ускладнены праз метадалагічныя праблемы ў даследаваннях і адрозненні паміж краінамі[90]. Штогадовыя выдаткі ў Вялікабрытаніі ацэньваюцца дыяпазонам паміж 449 млн і 3,3 млрд фунтаў стэрлінгаў, калі ў ЗША штогадовыя выдаткі на аднаго пацыента складаюць каля 10 000 долараў, а агульнанацыянальныя штогадовыя затраты — каля 23 млрд долараў[90]. У ЗША найбольшыя прамыя кошты ідуць на дапамогу пацыентам стацыянараў і дамоў састарэлых, калі непасрэдныя выдаткі на лекі істотна ніжэйшыя[90]. Непрамыя затраты высокія ў сувязі са змяншэннем прадукцыйнасці працы і павелічэннем нагрузкі людзей, якія даглядаюць хворых — іх блізкіх сваякоў[90]. Акрамя чыста эканамічнага пашкоджання, хвароба Паркінсона значна зніжае якасць жыцця як хворых, гэтых і іх апекуноў[90].
Прапаганда і асветніцтва[правіць | правіць зыходнік]
11 красавіка, дзень нараджэння Джэймса Паркінсона, быў абвешчаны Сусветным Днём хваробы Паркінсона[91]. Чырвоны цюльпан быў абраны міжнароднымі арганізацыямі сімвалам хваробы ў 2005 годзе: менавіта гэты сорт быў зарэгістраваны пад назвай «Цюльпан Джэймса Паркінсона» (англ.: James Parkinson Tulip) у 1981 годзе нідэрландскім селекцыянерам[91]. Найбуйнейшыя грамадскія арганізацыі ў гэтай галіне ўключаюць: Нацыянальны Фонд Паркінсона, які выдзеліў больш за 180 млн долараў на апеку хворых, даследаванні і службы падтрымкі хворых і іх родных з 1982 г.[92]; Фонд Хваробы Паркінсона, які ахвяраваў 105 млн долараў на даследаванні і 44 млн долараў на адукацыйныя і асветніцкія праграмы з даты свайго заснавання ў 1957 г. Уільямам Блэкам[93][94]; Амерыканская Асацыяцыя Хваробы Паркінсона, заснаваная ў 1961 г.[95]; Еўрапейская Асацыяцыя Хваробы Паркінсона, заснаваная ў 1992 г.[96]
Вядомыя людзі, якія сталі ахвярамі паркінсанізму[правіць | правіць зыходнік]
Хвароба паражае людзей самых розных сацыяльных груп і прафесій. Развіваючыся паступова, яна прыводзіць да зніжэння працаздольнасці хворага чалавека.

Сярод беларусаў адной з найбольш вядомых ахвяр хваробы Паркінсона быў Рыгор Іванавіч Барадулін — Народны паэт Беларусі, перакладчык і эсэіст.
Дадзенае захворванне было дыягнаставанае ў некаторых знакамітых палітыкаў, дзяржаўных і царкоўных дзеячаў. Дыягназ хваробы Паркінсона быў пастаўлены Папу Рымскаму Яну Паўлу II у 1993 годзе[97]. Афіцыйна Ватыканам хвароба пантыфіка была прызнана ў 2003 годзе[98]. Такім чынам Ян Павел II апошнія 12 гадоў жыццяў пакутаваў ад сімптомаў і праяў паркінсанізму. У апошнія гады жыцця кітайскі дзяржаўны дзеяч і дыктатар Маа Цзэдун адышоў ад палітычнай дзейнасці ў сувязі з гэтай немаччу, якая ў яго развілася[99][100]. У палесцінскага лідара Ясіра Арафата хвароба Паркінсона афіцыйна прызнана не была. Аднак наяўнасць у яго яскравага трэмару ў апошнія гады жыцця дала падставу меркаваць пра дадзенае захворванне[101][102]. Хвароба Паркінсона іспанскага дзяржаўнага дзеяча і дыктатара Франсіска Франка ў значнай ступені паўплывала на гісторыю Іспаніі. Па ўспамінах караля Хуана Карласа I «Франка быў чалавекам, створаным каб пражыць 100 гадоў. Не курыў, не піў і не быў вялікім гастраномам. Вёў абсалютна мернае жыццё і праводзіў шмат часу на паветры, займаючыся паляваннем або рыбнай лоўляю з борта „Асор“». Хвароба стала для яго вялікай неспадзяванкаю. Франка даў даручэнне падрыхтаваць дэкрэт пра перадачу ўлады і ў 1973 годзе сышоў з пасады старшыні ўрада[103].

Сярод прадстаўнікоў мастацтва і навуковага свету хвароба Паркінсона была дыягнаставаная ў каталонскага сюррэаліста Сальвадора Далі, знакамітага італьянскага і савецкага фізіка Бруна Пантэкорва[104], матэматыка Андрэя Калмагорава[105], брытанскага пісьменніка Артура Кёстлера і рускага паэта Андрэя Вазнясенскага. Сальвадору Далі дыягназ быў пастаўлены за 8 гадоў да смерці, у 1981 годзе[106]. У Артура Кёстлера сімптомы хваробы з’явіліся ў 1976 годзе. Нягледзячы на тое, што моцны трэмар у руках перашкаджаў яму пісаць[107][108], ён яшчэ стварыў некалькі твораў. Андрэй Вазнясенскі пасля 15 гадоў захворвання памёр ад яго ўскладненняў[109].
Да захворвання таксама схільныя спартсмены. Развіццё хваробы Паркінсона ў іх цягне за сабою сыход з прафесійнага спорту. У няпоўныя 40 гадоў у амерыканскага баксёра Махамеда Алі дыягнаставалі хваробу Паркінсона. Шматразовы чэмпіён быў вымушаны завершыць сваю спартыўную кар’еру[110][111]. Да іншых знакамітых спартсменаў-паркінсонікаў можна аднесці амерыканскіх аўтагоншчыка Філа Хіла[112] і баскетбаліста Браяна Гранта[113].
Сярод знакамітых кінаакцёраў хвароба Паркінсона была дыягнаставана ў Майкла Джэй Фокса, Дэборы Кер[114], Вінсента Прайса[115][116] і Робіна Вільямса[117]. Савецкі акцёр Міхаіл Ульянаў пакутаваў на захворванне апошнія 15 гадоў жыцця[118]. У амерыкана-канадскага акцёра Майкла Джэй Фокса хвароба была дыягнаставана ў 1991 годзе. Праз пэўны час ён стварыў грамадскую арганізацыю «Фонд Майкла Джэй Фокса» па даследаванні хваробы Паркінсона, якая дапамагае паркінсонікам і спансіруе даследаванні па вывучэнні праблемы[119]. Самому Фоксу была праведзена таламатамія[120][121][122].
Зноскі[правіць | правіць зыходнік]
- ↑ а б Disease Ontology — 2016. Праверана 15 мая 2019.
- ↑ а б Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018. Праверана 3 ліпеня 2018.
- ↑ Традыцыйная назва, якая выкарыстоўваецца на постсавецкай прасторы ў выніку транслітарацыі з рускай мовы.
- ↑ Назва, якая ўтворана ў выніку транслітарацыі з англійскай мовы з захаваннем традыцыйнага англійскага вымаўлення.
- ↑ а б The National Collaborating Centre for Chronic Conditions, рэд. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 59–100. ISBN 1-86016-283-5. (англ.)
- ↑ а б в г д е ё Lees A. J. Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday(англ.) // Mov Disord. — 2007. — Т. 22. — № Suppl 17. — С. S327—334. — PMID 18175393.
- ↑ а б в г д García Ruiz PJ. [Prehistory of Parkinson's disease](ісп.) // Neurologia. — 2004. — Т. 19. — С. 735—737. — PMID 15568171.
- ↑ а б в Lanska D. J. Chapter 33: the history of movement disorders(англ.) // Handb Clin Neurol. — 2010. — Т. 95. — С. 501—546. — PMID 19892136.
- ↑ Koehler P. J., Keyser A. Tremor in Latin texts of Dutch physicians: 16th-18th centuries(англ.) // Mov Disord. — 1997. — Т. 12. — С. 798—806. — PMID 9380070.
- ↑ Currier R. D. Did John Hunter give James Parkinson an idea?(англ.) // Arch Neurol. — 1996. — Т. 53. — С. 377—378. — PMID 8929162.
- ↑ а б Louis ED The shaking palsy, the first forty-five years: a journey through the British literature(англ.) // Mov Disord. — 1997. — Т. 12. — С. 1068—1072. — PMID 9399240.
- ↑ Lees A. J., Selikhova M., Andrade L. A., Duyckaerts C. The black stuff and Konstantin Nikolaevich Tretiakoff(англ.) // Mov Disord. — 2008. — Т. 23. — С. 777—783. — PMID 18383531.
- ↑ Parent M., Parent A. Substantia nigra and Parkinson’s disease: a brief history of their long and intimate relationship(англ.) // Can J Neurol Sci. — 2010. — Т. 37. — С. 313—319. — PMID 20481265.
- ↑ Fahn S. The history of dopamine and levodopa in the treatment of Parkinson’s disease(англ.) // Mov Disord. — 2008. — Т. 23. — № Suppl 3. — С. S497–508. — PMID 18781671.
- ↑ Schulz-Schaeffer WJ The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson's disease and Parkinson's disease dementia(англ.) // Acta Neuropathol. — 2010. — Т. 23. — С. 131–143. — PMID 20563819.
- ↑ Coffey R. J. Deep brain stimulation devices: a brief technical history and review(англ.) // Artif Organs. — 2009. — Т. 33. — С. 208–220. — PMID 18684199.
- ↑ а б в de Lau L. M., Breteler M. M. Epidemiology of Parkinson's disease // Lancet Neurol. — 2006. — Т. 5. — С. 525—535. — PMID 16713924. (англ.)
- ↑ а б [www.nbuv.gov.ua/portal/chem_biol/umch/2001_2/pdf/944_rus.pdf Паркопан — антихолинергический препарат для лечения экстрапирамидных двигательных нарушений] // Український медичний часопис. — 2001. — Т. 2. — № 22. — С. 49—52. (руск.)
- ↑ Samii A., Nutt J. G., Ransom B. R. Parkinson’s disease // Lancet. — 2004. — Т. 363. — С. 1783—1793. — PMID 15172778.
- ↑ а б в г д е ё ж з Артемьев Д. В., Голубев В. Л., Яхно Н. Н. Болезнь Паркинсона // Нервные болезни / Под редакцией Н. Н. Яхно, Д. Р. Штульмана. — М.:: Медицина, 2003. — Т. 2. — С. 76—96. — 512 с. — 5 000 экз. — ISBN 5-225-04663-0.
- ↑ «Ф.Хоффманн-Ля Рош Лтд.» (Базель, Швейцария). «Morbus Parkinson и ее лечение», Москва, 2000. (руск.)
- ↑ Tysnes OB, Vilming ST. "Atypical parkinsonism". PMID 18846125.
{{cite journal}}: Шаблон цытавання journal патрабуе|journal=(даведка) (англ.) - ↑ а б в de Lau L. M., Breteler M. M. (June 2006). "Epidemiology of Parkinson's disease". Lancet Neurol. 5 (6): 525–35. doi:10.1016/S1474-4422(06)70471-9. PMID 16713924. (англ.)
- ↑ Tanner C. M., Kamel F., Ross G. W.; et al. (January 2011). "Rotenone, Paraquat and Parkinson's Disease". Environ. Health Perspect. doi:10.1289/ehp.1002839. PMID 21269927.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) (англ.) - ↑ а б IOM (Institute of Medicine), рэд. (2009). "Neurologic disorders". Veterans and Agent Orange: Update 2008. Washington D.C.: The National Academies press. pp. 510–45. ISBN 0-309-13884-1. (англ.)
- ↑ Castagnoli K., Murugesan T. (January 2004). "Tobacco leaf, smoke and smoking, MAO inhibitors, Parkinson's disease and neuroprotection; are there links?". Neurotoxicology. 25 (1–2): 279–291. doi:10.1016/S0161-813X(03)00107-4. PMID 14697903. (англ.)
- ↑ Costa J., Lunet N., Santos C., Santos J., Vaz-Carneiro A. (2010). "Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies". J. Alzheimers Dis. 20. Suppl 1: S221–38. doi:10.3233/JAD-2010-091525. PMID 20182023.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) (англ.) - ↑ а б в Robert A. Hauser. Parkinson’s disease Patophysiology (англ.)(недаступная спасылка). Medscape (20 июня 2011). Архівавана з першакрыніцы 4 верасня 2011. Праверана 5 ліпеня 2011.
- ↑ а б Davie C. A. A review of Parkinson’s disease // Br Med Bull. — 2008. — Т. 86. — С. 109—127. — PMID 18398010.
- ↑ а б Tolosa E., Jankovic JJ. Parkinson’s disease and movement disorders // Neuropathology of movement disorders / Dickson D. V.. — Lippincott Williams & Wilkins. — 2007. — С. 271—283. — ISBN 0-7817-7881-6. (англ.)
- ↑ а б в Пулатов А. М., Никифоров А. С. Бледный шар и полосатое тело как основные отделы экстрапирамидной системы. Их строение, связи и функция // Пропедевтика нервных болезней. — 2-е. — Ташкент: Медицина, 1979. — С. 97—100. — 368 с. — 20 000 экз. (руск.)
- ↑ а б Дубенко Є. Г. Екстрапірамідна система // Нервові хвороби / Под редакцией С. М. Виничука, Е. Г. Дубенко. — К.:: Здоров’я, 2001. — С. 61—65. — 696 с. — 3 000 экз. — ISBN 5-311-01224-2. (укр.)
- ↑ Ted M. Dawsonsend, Han Seok Ko, Valina L. Dawson. Genetic Animal Models of Parkinson’s Disease. Neuron, Volume 66, Issue 5, 646—661, 10 June 2010 (англ.)
- ↑ Jeffrey H. Kordower, Marina E. Emborg, Jocelyne Bloch, Shuang Y. Ma, Yaping Chu, Liza Leventhal,1 Jodi McBride,1 Er-Yun Chen,1 Stéphane Palfi,1 Ben Zion Roitberg,1 W. Douglas Brown, James E. Holden, Robert Pyzalski, Michael D. Taylor, Paul Carvey, ZaoDung Ling, Didier Trono, Philippe Hantraye, Nicole Déglon, and Patrick Aebischer. Neurodegeneration Prevented by Lentiviral Vector Delivery of GDNF in Primate Models of Parkinson’s Disease. Science, Vol. 290, pp. 767—773 (October 27, 2000). (англ.)
- ↑ Eslamboli A. Marmoset monkey models of Parkinson’s disease: which model, when and why? Brain Res Bull. 2005 Dec 30;68(3):140-9. Epub 2005 Sep 7. (англ.)
- ↑ а б в Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". J. Neurol. Neurosurg. Psychiatr. [англійская]. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392.
- ↑ Cooper G, Eichhorn G, Rodnitzky RL (2008). "Parkinson's disease". In Conn PM (рэд.). Neuroscience in medicine. Totowa, NJ: Humana Press. pp. 508–512. ISBN 978-1-60327-454-8.
{{cite book}}: Папярэджанні CS1: розныя назвы: authors list (link) (англ.) - ↑ а б в г д е ё ж Дубенко Є. Г. Розділ 23. Хвороба Паркінсона // Нервові хвороби / Под редакцией С. М. Виничука, Е. Г. Дубенко. — К.:: Здоров’я, 2001. — С. 465—469. — 696 с. — 3 000 экз. — ISBN 5-311-01224-2. (укр.)
- ↑ а б в г д е ё ж з і Пулатов А. М., Никифоров А. С. Клинические проявления поражения стриопаллидарной системы // Пропедевтика нервных болезней. — 2-е. — Ташкент: Медицина, 1979. — С. 100—105. — 368 с. — 20 000 экз. (руск.)
- ↑ а б в г д е Триумфов А. В. Паркинсонизм // Топическая диагностика заболеваний нервной системы. — М.:: ООО "МЕДпресс", 1998. — С. 194—195. — 304 с. — 5 000 экз. — ISBN 5-900990-04-4. (руск.)
- ↑ Доброхотова Т. А., Засорина М. А. Паркинсонизм // Нейропсихиатрия / Доброхотова Т. А.. — М.:: Издательство БИНОМ, 2006. — С. 223—226. — 304 с. — 2 000 экз. — ISBN 5-9518-0151-6. (руск.)
- ↑ Гусев Е. И., Коновалов А. Н., Бурд Г. С. Болезнь Паркинсона // Неврология и нейрохирургия. — М.:: Медицина, 2000. — С. 586—591. — 656 с. — 20 000 экз. — ISBN 5-225-00969-7. (руск.)
- ↑ Guidelines Дакументы Еўрапейскай асацыяцыі хваробы Паркінсона Архівавана 3 снежня 2013.
- ↑ Hughes A. J. et al. UK Parkinson’s Disease Society Brain Bank Clinical Diagnostic Criteria // J Neurol Neurosurg Psychiatry. — 1992. — Т. 55. — С. 181—184. (англ.)
- ↑ Hoehn and Yahr Stages (англ.)(недаступная спасылка). сайт parkinsons.about.com. Архівавана з першакрыніцы 12 лістапада 2011. Праверана 12 верасня 2011.
- ↑ Progression of Parkinson`s disease (англ.)(недаступная спасылка). сайт parkinsons.bsd.uchicago.edu. Архівавана з першакрыніцы 22 студзеня 2012. Праверана 12 верасня 2011.
- ↑ Hoehn M. M., Yahr M. D. Parkinsonism: onset, progression and mortality // Neurology. — 1967. — Т. 17. — С. 427—442. — PMID 6067254. (англ.)
- ↑ Goetz CG, Poewe W, Rascol O, Sampaio C, Stebbins GT, Counsell C, Giladi N, Holloway RG, Moore CG, Wenning GK, Yahr MD, Seidl L Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations // Mov Disord. — 2004. — Т. 19. — С. 1020—1028. — PMID 15372591. (англ.)
- ↑ а б в г д Машковский М. Д. Противопаркинсонические дофаминергические препараты // Лекарственные средства. — 14-е изд., перераб., испр. и доп. — М.:: ООО "Издательство Новая Волна", 2002. — Т. 1. — С. 140—144. — 540 с. — ISBN 5-7864-0128-6. (руск.)
- ↑ Rowland, Lewis P. Rowland, Timothy A. Pedley. Merritt's Neurology. — Lippincott Williams & Wilkins, 2009. — 1216 с. — ISBN 9780781791861. (англ.)
- ↑ а б Михайлов Н. Б. 16.5.2 Средства, стимулирующие дофаминовые рецепторы на нейронах стриарной системы // Настольная книга врача по клинической фармакологии. — Руководство для врачей. — СПб.:: Фолиант, 2001. — С. 470—471. — 736 с. — 3 000 экз. — ISBN 5-93929-025-6. (руск.)
- ↑ Stowe RL, Ives NJ, Clarke C, van Hilten J, Ferreira J, Hawker RJ, Shah L, Wheatley K, Gray R. "Dopamine agonist therapy in early Parkinson's disease". PMID 18425954.
{{cite journal}}: Шаблон цытавання journal патрабуе|journal=(даведка) (англ.) - ↑ Михайлов Н. Б. 16.5.3 Ингибиторы ферментов (МАО-Б и КОМТ), разрушающих эндогенный дофамин и дофаминомиметики // Настольная книга врача по клинической фармакологии. — Руководство для врачей. — СПб.:: "Фолиант", 2001. — С. 471—472. — 736 с. — 3 000 экз. — ISBN 5-93929-025-6. (руск.)
- ↑ а б в г д Машковский М. Д. Противопаркинсонические антихолинергические препараты // Лекарственные средства. — 14-е изд., перераб., испр. и доп. — М.:: ООО "Издательство Новая Волна", 2002. — Т. 1. — С. 137—140. — 540 с. — ISBN 5-7864-0128-6. (руск.)
- ↑ Hua S. E., Garonzik I. M., Lee J.-I., Lenz F. A. Chapter 170 Thalamotomy for Tremor. (Tremor of Parkinson's Disease) // Youmans Neurological Surgery / H. R. Winn. — 5th. — Philadelphia: SAUNDERS, 2004. — С. 2774—2776. — ISBN 0-7216-8291-x. (англ.)
- ↑ а б в Jankovic J., Cardoso F., Grossman R. G., Hamilton W. J. Outcome after stereotactic thalamotomy for parkinsonian, essential, and other types of tremor // Neurosurgery. — 1995. — Т. 37. — С. 680—686. — PMID 8559296. (англ.)
- ↑ Hallett M., Litvan I. Evaluation of surgery for Parkinson’s disease: a report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. The Task Force on Surgery for Parkinson's Disease // Neurology. — 1999. — Т. 53. — С. 1910—1921. — PMID 10599758. (англ.)
- ↑ Zirh TA, Lenz FA, Reich SG, Dougherty PM. Patterns of bursting occurring in thalamic cells during parkinsonian tremor // Neuroscience. — 1998. — Т. 83. — С. 107—121. — PMID 9466402. (англ.)
- ↑ Lenz F. A., Vitek J. L., DeLong M. R. Role of the thalamus in parkinsonian tremor: evidence from studies in patients and primate models // Stereotact Funct Neurosurg. — 1993. — Т. 60. — С. 94—103. — PMID 8511438. (англ.)
- ↑ а б Fox M. W., Ahlskog J. E., Kelly P. J. Stereotactic ventrolateralis thalamotomy for medically refractory tremor in post-levodopa era Parkinson's disease patients // J Neurosurg. — 1991. — Т. 75. — С. 723—730. — PMID 1919694. (англ.)
- ↑ Lozano A. M., Alkhani A. Chapter 171. Pallidotomy for Parkinson`s Disease // Youmans Neurological Surgery / H. R. Winn. — 5th. — Philadelphia: SAUNDERS, 2004. — С. 2785—2801. — ISBN 0-7216-8291-x. (англ.)
- ↑ Lang A. E., Lozano A. M., Montgomery E., Duff J., Tasker R., Hutchinson W. Posteroventral medial pallidotomy in advanced Parkinson's disease // N Engl J Med. — 1997. — Т. 337. — С. 1036-1042. — PMID 9321531. (англ.)
- ↑ Hirai T., Ryu H., Nagaseki Y., Gaur M. S., Fujii M., Takizawa T. Image-guided electrophysiologically controlled posteroventral pallidotomy for the treatment of Parkinson's disease: a 28-case analysis // Adv Neurol. — 1999. — Т. 80. — С. 585-591. — PMID 10410775. (англ.)
- ↑ Friedman D. P., Goldman H. W., Flanders A. E., Gollomp S. M., Curran W. J. Jr. Stereotactic radiosurgical pallidotomy and thalamotomy with the gamma knife: MR imaging findings with clinical correlation--preliminary experience // Radiology. — 1999. — Т. 212. — С. 143-150. — PMID 10405733. (англ.)
- ↑ Young R. F., Vermeulen S., Posewitz A., Shumway-Cook A. Pallidotomy with the gamma knife: a positive experience // Stereotact Funct Neurosurg. — 1998. — Т. 70. — С. Suppl 1:218—228. — PMID 9782254. (англ.)
- ↑ Young R. F. Gamma knife radiosurgery as an alternative form of therapy for movement disorders // Arch Neurol. — 2002. — Т. 59. — С. 1660—1662. — PMID 12374507. (англ.)
- ↑ Young R. F., Shumway-Cook A., Vermeulen S. S., Grimm P., Blasko J., Posewitz A., Burkhart W. A., Goiney R. C. Gamma knife radiosurgery as a lesioning technique in movement disorder surgery // J Neurosurg. — 1998. — Т. 89. — С. 182—193. — PMID 9688111. (англ.)
- ↑ Шабалов В. А., Томский А. А.. Паркинсонизм(недаступная спасылка). www.gofn.ru. Архівавана з першакрыніцы 24 жніўня 2011. Праверана 20 ліпеня 2011. (англ.)
- ↑ а б Raoul S., N’Guyen J.-P. Surgery for Parkinson’s disease // Essential Practice of Neurosurgery / Editor in Chief Kazadi Kalangu; Deputy editors Yoko Kato&Gilbert Dechambenoit. — Nagoya, Japan: Yamagiku Printing Co., Ltd., 2009. — С. 1077—1084. — 1496 с. — ISBN 978-4-904992-01-2. (англ.)
- ↑ About Medtronic Deep Brain Stimulation Therapy (англ.)(недаступная спасылка). www.medtronicdbs.com. Архівавана з першакрыніцы 3 верасня 2011. Праверана 10 ліпеня 2011.
- ↑ F. J. G. Vingerhoets, MD, J.-G. Villemure, MD FRCSC, P. Temperli, MD, C. Pollo, MD, E. Pralong, MD PhD and J. Ghika, MD Subthalamic DBS replaces levodopa in Parkinson’s disease. Two-year follow-up(англ.) // Neurology. — 2002. — Т. 58. — С. 396—401.
- ↑ Steven Ertelt. Adult Stem Cell Research Reverses Effects of Parkinson’s Disease in Human Trial (англ.)(недаступная спасылка). LifeNews.com (2009—02—16). Архівавана з першакрыніцы 17 жніўня 2011. Праверана 21 ліпеня 2011.
- ↑ Stem Cell Research Aims to Tackle Parkinson’s Disease (англ.)(недаступная спасылка). ScienceDaily (2008—01—20). Архівавана з першакрыніцы 9 жніўня 2011. Праверана 21 ліпеня 2011.
- ↑ Breakthrough produces Parkinson's patient-specific stem cells free of harmful reprogramming genes (англ.)(недаступная спасылка) (2008—03—05). Архівавана з першакрыніцы 25 лістапада 2010. Праверана 21 ліпеня 2011.
- ↑ Borthwick L.. Stem cells improve Parkinson's disease symptoms (англ.)(недаступная спасылка). www.nature.com. Архівавана з першакрыніцы 8 жніўня 2011. Праверана 10 ліпеня 2011.
- ↑ Einat Rotman. Gene Therapy Improves Parkinson’s Symptoms (англ.)(недаступная спасылка). сайт thefutureofthings.com (28 студзеня 2008). Архівавана з першакрыніцы 1 чэрвеня 2012. Праверана 27 жніўня 2011.
- ↑ 55-летний Натан Кляйн (Nathan Klein) — первый в мире пациент, прооперированный по методу генной терапии от болезни Паркинсона(недаступная спасылка). www.fotobank.com. Архівавана з першакрыніцы 22 студзеня 2012. Праверана 27 жніўня 2011. (руск.)
- ↑ Gene therapy offers hope for easing Parkinson’s (англ.)(недаступная спасылка). www.msnbc.msn.com. Архівавана з першакрыніцы 12 лістапада 2011. Праверана 27 жніўня 2011.
- ↑ а б в г д Poewe W. The natural history of Parkinson's disease // J Neurol. — 2006. — Т. 253. — С. 7:VII2-6. — PMID 17131223. (англ.)
- ↑ а б Obeso J. A., Rodriguez-Oroz M. C., Goetz C. G., Marin C., Kordower J. H., Rodriguez M., Hirsch E. C., Farrer M., Schapira A. H., Halliday G. Missing pieces in the Parkinson's disease puzzle // Nat Med. — 2010. — Т. 16. — С. 653—661. — PMID 20495568. (англ.)
- ↑ а б в г д The National Collaborating Centre for Chronic Conditions, рэд. (2006). "Other key interventions". Parkinson's Disease. London: Royal College of Physicians. pp. 135–46. ISBN 1-86016-283-5. Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 24 верасня 2010. Праверана 17 чэрвеня 2014.Архіўная копія(недаступная спасылка). Архівавана з першакрыніцы 24 верасня 2010. Праверана 17 чэрвеня 2014. (англ.)
- ↑ а б Goodwin VA, Richards SH, Taylor RS, Taylor AH, Campbell JL; Richards; Taylor; Taylor; Campbell (April 2008). "The effectiveness of exercise interventions for people with Parkinson's disease: a systematic review and meta-analysis". Mov. Disord. 23 (5): 631–40. doi:10.1002/mds.21922. PMID 18181210.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) (англ.) - ↑ Dereli EE, Yaliman A; Yaliman (April 2010). "Comparison of the effects of a physiotherapist-supervised exercise programme and a self-supervised exercise programme on quality of life in patients with Parkinson's disease". Clin Rehabil. 24 (4): 352–62. doi:10.1177/0269215509358933. PMID 20360152.(недаступная спасылка) (англ.)
- ↑ O'Sullivan & Schmitz 2007, pp. 873, 876 (англ.)
- ↑ O'Sullivan & Schmitz 2007, p. 879 (англ.)
- ↑ O'Sullivan & Schmitz 2007, p. 877 (англ.)
- ↑ O'Sullivan & Schmitz 2007, p. 880 (англ.)
- ↑ Fox CM, Ramig LO, Ciucci MR, Sapir S, McFarland DH, Farley BG; Ramig; Ciucci; Sapir; McFarland; Farley (November 2006). "The science and practice of LSVT/LOUD: neural plasticity-principled approach to treating individuals with Parkinson disease and other neurological disorders". Semin. Speech. Lang. 27 (4): 283–99. doi:10.1055/s-2006-955118. PMID 17117354.
{{cite journal}}: Папярэджанні CS1: розныя назвы: authors list (link) (англ.) - ↑ Dixon L.; Duncan D.; Johnson P.; Kirkby; O'Connell; Taylor; Deane (2007). Deane, Katherine (рэд.). "Occupational therapy for patients with Parkinson's disease". Cochrane Database of Systematic Reviews [англійская] (3): CD002813. doi:10.1002/14651858.CD002813.pub2. PMID 17636709.
- ↑ а б в г д Findley LJ (September 2007). "The economic impact of Parkinson's disease". Parkinsonism Relat. Disord. 13 (Suppl): S8–S12. doi:10.1016/j.parkreldis.2007.06.003. PMID 17702630. (англ.)
- ↑ а б Parkinson's – 'the shaking palsy'(недаступная спасылка). GlaxoSmithKline (1 красавіка 2009). Архівавана з першакрыніцы 14 мая 2011. Праверана 17 кастрычніка 2014. (англ.)
- ↑ National Parkinson Foundation – Mission(недаступная спасылка). Архівавана з першакрыніцы 21 снежня 2010. Праверана 28 March 2011. (англ.)
- ↑ "Education: Joy in Giving". Time. 18 January 1960. Архівавана з арыгінала 20 лютага 2011. Праверана 2 April 2011. (англ.)
- ↑ About PDF(недаступная спасылка). Parkinson's Disease Foundation. Архівавана з першакрыніцы 15 мая 2011. Праверана 14 October 2014. (англ.)
- ↑ American Parkinson Disease Association: Home(недаступная спасылка). American Parkinson Disease Association. Архівавана з першакрыніцы 10 мая 2012. Праверана 9 August 2010. (англ.)
- ↑ About EPDA. European Parkinson's Disease Association (2010). Праверана 9 August 2010. (англ.)
- ↑ Pope John Paul II and Parkinson’s Disease (англ.)(недаступная спасылка). parkinsons.about.com (26 красавіка 2005). Архівавана з першакрыніцы 12 лістапада 2011. Праверана 8 жніўня 2011.
- ↑ а б Иоанн Павел II страдает от болезни Паркинсона(недаступная спасылка). newsinfo.ru. Архівавана з першакрыніцы 4 сакавіка 2016. Праверана 22 ліпеня 2011. (руск.)
- ↑ Мао Цзэдун(недаступная спасылка). vseportrety.ru. Архівавана з першакрыніцы 4 сакавіка 2016. Праверана 22 ліпеня 2011. (руск.)
- ↑ Mao Zedong Biography (англ.). Encyclopedia of World Biography. Праверана 10 жніўня 2011.
- ↑ Ясир Арафат улетел в Париж на лечение. Возможно, у него болезнь Паркинсона(недаступная спасылка). newsru.com (29 кастрычніка 2011). Архівавана з першакрыніцы 12 лістапада 2011. Праверана 10 ліпеня 2011. (руск.)
- ↑ Leaders in emergency meeting as Arafat ‘in coma’ (англ.)(недаступная спасылка). Daily Mail. Архівавана з першакрыніцы 25 сакавіка 2012. Праверана 8 жніўня 2011.
- ↑ Пожарская С. П. Франсиско Франко и его время. — М.:: ОЛМА Медиа Групп, 2007. — С. 339—340. — 410 с. — ISBN 978-5-373-00591-3. (руск.)
- ↑ Герштейн С. С.. Воспоминания и размышления о Бруно Понтекорво(недаступная спасылка). Vivos Voco. Архівавана з першакрыніцы 12 лістапада 2011. Праверана 12 жніўня 2011. (руск.)
- ↑ Успенский В. А. Колмогоров, каким я его помню // В сб.: Колмогоров в воспоминаниях учеников, 2-е издание. — Москва: МЦНМО, 2006. — С. 274. — ISBN 5-94057-198-0. Архівавана з першакрыніцы 24 жніўня 2014. (руск.)
- ↑ Salvador Dali (англ.)(недаступная спасылка). famouspainter.com. Архівавана з першакрыніцы 14 верасня 2011. Праверана 11 жніўня 2011.
- ↑ Arthur Koestler(недаступная спасылка). NNDB.com. Архівавана з першакрыніцы 7 ліпеня 2011. Праверана 22 ліпеня 2011. (англ.)
- ↑ Cesarani, David. Arthur Koestler: The Homeless Mind. — William Heinemann, 1998. — С. 535. — ISBN 0434113050. (англ.)
- ↑ Писательница Зоя Богуславская, вдова Вознесенского: Андрей умер от болезни Паркинсона, а не от инфаркта или инсульта(недаступная спасылка). nnov.kp.ru. Архівавана з першакрыніцы 10 сакавіка 2013. Праверана 22 ліпеня 2011. (руск.)
- ↑ Мохаммед Али(недаступная спасылка). superboxing.net. Архівавана з першакрыніцы 13 кастрычніка 2011. Праверана 8 жніўня 2011. (руск.)
- ↑ The world’s champion (англ.)(недаступная спасылка). vitapro.com. Архівавана з першакрыніцы 24 жніўня 2011. Праверана 10 ліпеня 2011. (англ.)
- ↑ Phil Hill (1927–2008)(недаступная спасылка). f1ronspeak.wordpress.com. Архівавана з першакрыніцы 31 сакавіка 2016. Праверана 22 ліпеня 2011. (англ.)
- ↑ Grant takes charge of Parkinson’s battle(недаступная спасылка). sports.espn.go.com. Архівавана з першакрыніцы 13 лістапада 2011. Праверана 10 ліпеня 2011. (англ.)
- ↑ Дебора Керр(недаступная спасылка). kinofilms.com.ua. Архівавана з першакрыніцы 2 верасня 2017. Праверана 22 ліпеня 2011. (англ.)
- ↑ Винсент Прайсс(недаступная спасылка). horror-movies.ru. Архівавана з першакрыніцы 11 кастрычніка 2011. Праверана 22 ліпеня 2011. (руск.)
- ↑ Vincent Price(недаступная спасылка). Find a Grave. Архівавана з першакрыніцы 6 ліпеня 2011. Праверана 12 жніўня 2011. (англ.)
- ↑ Робин Уильямс страдал от болезни Паркинсона, сообщила его жена. РИА Новости (14 августа 2014). Праверана 15 августа 2014. (англ.)
- ↑ Виталий Бродзкий. Елена Ульянова: «Дома отец был страшно мягким» (руск.)(недаступная спасылка). WomanHit (22 ноября 2012). Архівавана з першакрыніцы 2 лістапада 2014. Праверана 2013-6-9. (руск.)
- ↑ Фонд Майкла Джея Фокса выделяет 1,5 млн евро фармакологическому предприятию из Турку // Сайт тэлерадыёкампаніі Yleisradio Oy. Novosti po-russki. — 8 ліпеня 2014.(Праверана 27 красавіка 2024) (руск.)
- ↑ Anne Harding. Brain implant better than meds for Parkinson’s disease (англ.)(недаступная спасылка). CNN (6 января 2009). Архівавана з першакрыніцы 2 лютага 2012. Праверана 8 жніўня 2011.
- ↑ The Michael J. Fox Foundation for Parkinson’s Research (англ.)(недаступная спасылка). michaeljfox.org. Архівавана з першакрыніцы 30 жніўня 2011. Праверана 22 ліпеня 2011.
- ↑ Fox Quits Spin City (англ.)(недаступная спасылка). BBC News (19 января 2000). Архівавана з першакрыніцы 12 лістапада 2011. Праверана 8 жніўня 2011.
Літаратура[правіць | правіць зыходнік]
- O'Sullivan SB, Schmitz TJ (2007). "Parkinson's Disease". Physical Rehabilitation [англійская] (5th ed.). F.A. Davis. ISBN 978-0-8036-1247-1.
Спасылкі[правіць | правіць зыходнік]
 На Вікісховішчы ёсць медыяфайлы па тэме Хвароба Паркінсона
На Вікісховішчы ёсць медыяфайлы па тэме Хвароба Паркінсона- Здаровая тэма.ru — хвароба Паркінсона на сайце медыцынскага даведніка «Здаровая тэма» (руск.: Здоровая тема). (руск.)
- The Parkinson’s Disease Forum Архівавана 11 снежня 2006. (англ.).
Гэты артыкул уваходзіць у лік выдатных артыкулаў беларускамоўнага раздзела Вікіпедыі. |
