Спірты


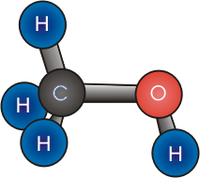
Спірты́[2] (ад лац.: spiritus — дух; устар. алкаго́лі) — арганічнае злучэнне, якія змяшчаюць адну або больш гідраксільных груп (гідраксіл, −OH), непасрэдна злучаных з насычаным (у стане sp³-гібрыдызацыі) атамам вадароду[3]. Спірты можна разглядаць як вытворныя вады (H−O−H), у якіх адзін атам вадароду замешчаны на арганічную функцыянальную групу: R−O−H.
У наменклатуры IUPAC для злучэнняў, у якіх гідраксільная група звязана з ненасычаным (sp²-гібрыдным) атамам вугляроду, рэкамендуюцца назвы «енолы» (гідраксіл злучаны з вінільнай C=C-сувяззю)[4] і «фенолы» (гідраксіл злучаны з бензольным або іншым водарным цыклам)[5].
Спірты ўяўляюць сабой шырокі і разнастайны клас злучэнняў: яны вельмі пашыраны ў прыродзе і часта выконваюць важныя функцыі ў жывых арганізмах. Спірты з’яўляюцца важнымі злучэннямі з пункту гледжання арганічнага сінтэзу, не толькі ўяўляючы цікавасць як мэтавыя прадукты, але і як прамежкавыя рэчывы, якія маюць шэраг унікальных хімічных уласцівасцяў. Акрамя таго, спірты з’яўляюцца прамыслова важнымі прадуктамі і знаходзяць найшырэйшае ўжыванне як у прамысловасці, так і ў паўсядзённых дастасаваннях. Некаторыя шмататамныя спірты ўваходзяць у склад замяняльнікаў цукру.
У агульным ужытку часцей за ўсё пад словам «спірт» разумеецца этанол (CH3-CH2-OH), які атрымліваецца пры браджэнні цукру і з’яўляецца асновай алкагольных напояў, таксама шырока ўжываецца ў тэхніцы ды медыцыне.
Этымалогія
[правіць | правіць зыходнік]Слова алкаго́ль у беларускую мову, як і ва ўсе мовы Еўропы, патрапіла з латыні. Свой жа пачатак бярэ ад сярэдневяковага араб. اَلْكُحْل (al-kuḥl) — «парашкападобная сурма»[6], якое, у сваю чаргу, праз арам.: כוחלא/ܟܘܚܠܐ (kuḥlā) запазычана з акад.: 𒎎𒋆𒁉𒍣𒁕 (guḫlum) з тым жа значэннем. Паняцце ўзнікла ад алхімічнай методыкі аднаўлення хімічных рэчываў да «парашку», які з’яўляецца, як меркавалася, чыстай эсэнцыяй рэчыва. Падобным чынам, і этылавы спірт з’яўляецца эсэнцыяй віна, ад чаго і адбылася ягоная трывіяльная назва «вінны спірт»[6].
Слова спірт з’явілася ў беларускай мове праз рускую, якая ў часы маскоўскага цара Пятра I пераняла англійскае слова spirit, у сваю чаргу, вытворнае ад лацінскага spīritus — «дыханне, дух, душа»[7].
Класіфікацыя спіртоў
[правіць | правіць зыходнік]Спірты класіфікуюцца наступным чынам (у дужках прыведзены прыклады)[8]:
- Паводле колькасці гідраксільных груп:
- аднаатамныя спірты (метанол);
- двухатамныя спірты (этыленгліколь);
- трохатамныя спірты (гліцэрына);
- чатырохатамныя спірты (пентаэрытрыт);
- шмататамныя спірты (пяціатамны спірт: ксіліт).
- У залежнасці ад насычанасці вуглевадароднага замяшчальніка:
- гранічныя (насычаныя) спірты (бутанол);
- негранічныя (ненасычаныя) спірты (алілавы спірт, прапаргілавы спірт);
- водарныя спірты (бензілавы спірт).
- У залежнасці ад наяўнасці або адсутнасці цыклу ў вуглевадародным замяшчальніку:
- ацыклічныя (аліфатычныя) спірты (этанол);
- аліцыклічныя спірты (цыклагексанол).
- У залежнасці ад колькасці замяшчальнікаў пры α-вугляродным атаме:
- першасныя спірты (этанол);
- другасныя спірты (прапанол-2);
- троесныя спірты (2-метылпрапанол-2).
Наменклатура спіртоў
[правіць | правіць зыходнік]Сістэматычная наменклатура
[правіць | правіць зыходнік]Паводле наменклатуры IUPAC назвы простых спіртоў утвараюцца ад назваў адпаведных алканаў з даданнем суфікса «-ол», палажэнне якога ўказваецца арабскай лічбай.
Правілы пабудовы назваў спіртоў[9]:
- Выбіраюць бацькоўскі вуглевадарод па самым доўгім бесперапынным вуглевадародным ланцугу, утрымліваючым гідраксільную групу. Ён складае базавую назву (па колькасці атамаў вугляроду).
- Бацькоўскі вуглевадарод нумаруюць у такім напрамку, каб гідраксільная група атрымала найменшы нумар у назве. Калі ж у злучэнні маюцца функцыянальныя групы старэйшыя за гідраксільную, то гэтае правіла ўжываецца да старэйшай функцыянальнай групы.
- Старэйшая функцыянальная група пазначаецца ў выглядзе суфікса (для гідраксільнай — -ол), а астатнія замяшчальнікі — у выглядзе прыставак у алфавітным парадку. Іхняе становішча ў вуглевадародным ланцугу абазначаецца праз лічбы — лаканты, якія змяшчаюцца пасля суфіксаў і перад прыстаўкамі[10]. Для шмататамных спіртоў перад суфіксам -ол паказваецца колькасць гідраксільных груп (-дыёл, -трыёл, -тэтраол і г. д.).
- Калі пры розных варыянтах нумарацыі ланцуга гідраксільная група атрымлівае адзін і той жа лакант, то ланцуг нумаруюць у тым напрамку, пры якім іншы замяшчальнік атрымлівае найменшы лакант.
Іншыя наменклатуры
[правіць | правіць зыходнік]- Радыкала-функцыянальная наменклатура. У рамках гэтай наменклатуры назва ўтвараецца ад назвы класа злучэння (спірт) з дабаўленнем назваў радыкалаў, далучаных да гідраксільнай групы, напрыклад: этылавы спірт C2H5OH, гексілавы спірт C6H13OH, алілавы спірт СH2=CH−CH2OH.
- Рацыянальная наменклатура (карбінольная наменклатура) спіртоў разглядае іх як вытворныя метанолу CH3OH, званага ў гэтым выпадку карбінолам: дыметылкарбінол (СH3)2СНOH, трыфенілкарбінол (С6H5)3COH.
- Трывіяльная наменклатура. У папулярнай і навуковай літаратуры можна нярэдка сустрэць гістарычныя, ці трывіяльныя, назвы спіртоў, якія з прычыны складзенай традыцыі выкарыстоўваюцца замест сістэматычных назваў[11]. Трывіяльныя назвы звычайна паходзяць ад назвы прыроднай крыніцы атрымання таго ці іншага спірту. Так, напрыклад, метанол называюць драўняным спіртам, этанол — вінным спіртам, гераніол змяшчаецца ў гераніевым алеі, а цэтылавы спірт раней атрымлівалі з тлушчу кашалотаў[12] (лац.: cetus — кіт). Некаторыя спірты атрымалі трывіяльныя назвы праз свае фізічныя ўласцівасці (гліцэрына ад стар.-грэч.: γλῠκερός, glykeros — салодкі)[6]. Спірты, вытворныя ад прыродных вугляводаў, захоўваюць корань трывіяльнай назвы адпаведных вугляводаў (маніт, ксіліт, сарбіт).
Гісторыя адкрыцця спіртоў
[правіць | правіць зыходнік]Хмельны раслінны напой, які змяшчае этанол, вядомы чалавецтву з глыбокай старажытнасці. Лічыцца, што не менш чым за 8000 гадоў да нашай эры людзі былі знаёмыя з дзеяннем закіслых садавіны, а пазней — з дапамогай закісання атрымлівалі хмельныя напоі з этанолам у ім з садавіны і мёду[13]. Археалагічныя знаходкі сведчаць, што ў Заходняй Азіі вінаробства існавала яшчэ ў 5400—5000 гадах да н. э., а на прасторах сучаснага Кітая, правінцыя Хэнань, знойдзены сведчанні вытворчасці ферментаваных сумесяў з рысу, мёду, вінаграду і, магчыма, іншай садавіны, у эпоху ранняга неаліту: ад 6500 да 7000 гг. да н. э.[14]
Важнае адкрыццё, пра якое ўпершыню сведчыць адзін з твораў, прыпісваных Джабіру ібн-Хаяну (IX ст. н. э.), зводзілася да таго, што даданне солі ў кіпячае віно павялічвае адносную лятучасць віна, і можа павысіць узгаральнасць утвораных пар[15].
Упершыню спірт з віна атрымалі ў VI—VII стагоддзях арабскія хімікі; спосаб атрымання спірту змяшчаецца ў запісах персідскага алхіміка ар-Разі[16]. У Еўропе этылавы спірт быў атрыманы з прадуктаў закісання ў XI—XII стагоддзях, у Італіі[17].
Да ўсходніх славян чысты спірт упершыню трапіў у 1386 годзе, калі генуэзскае пасольства прывезла яго з сабой пад назвай «аква-віта» і прэзентавала велікакняжацкаму двару ў Маскве ў тагачасным княстве Уладзімірскім[18].
У 1661 годзе англійскі хімік Роберт Бойль упершыню атрымаў метанол перагонкай драўніны[19]. Абсалютаваны этанол з ягонага воднага раствору быў упершыню атрыманы ў 1796 годзе расійскім хімікам Т. Я. Ловіцам пры перагонцы над паташам[17][20].
У 1842 годзе нямецкі хімік Я. Г. Шыль адкрыў, што спірты ўтвараюць гамалагічны рад, адрозніваючыся на некаторую сталую велічыню. Аднак, ён памыліўся, апісаўшы яе як C2H2. Праз два гады, іншы хімік Шарль Жэрар устанавіў правільную гамалагічную розніцу CH2 і прадказаў формулу і ўласцівасці невядомага ў тыя гады прапілавага спірту[21]. У 1850 годзе англійскі хімік Аляксандр Уільямсан, даследуючы рэакцыю алкагалятаў з этылёдыдам, устанавіў, што этылавы спірт з’яўляецца вытворным вады з адным замешчаным атамам вадароду, эксперыментальна пацвердзіўшы формулу C2H5OH[22]. Упершыню сінтэз этанолу дзеяннем сернай кіслаты на этылен здзейсніў у 1854 годзе французскі хімік Марселен Бертло[22].
Першае даследаванне метылавага спірту было зроблена ў 1834 годзе французскімі хімікамі Жанам-Батыстам Дзюма і Эжэнам Пеліго. Яны назвалі яго «метылавым або драўняным спіртам», бо ён быў знойдзены ў прадуктах сухой перагонкі драўніны[23]. Сінтэз метанолу з метылхларыду ажыццявіў французскі хімік Марселен Бертло ў 1857 годзе[24]. Ім жа ў 1855 годзе быў адкрыты ізапрапілавы спірт, атрыманы дзеяннем сернай кіслаты на прапілен[25].
Упершыню троесны спірт (2-метылпрапанол-2) сінтэзаваў у 1863 годзе вядомы рускі хімік А. М. Бутлераў, паклаўшы пачатак цэлай серыі эксперыментаў у гэтым напрамку[22].
Двухатамны спірт этыленгліколь упершыню быў сінтэзаваны французскім хімікам А. Вюрцам у 1856 годзе[21]. Гліцэрына быў знойдзены ў прыродных тлушчах яшчэ ў 1783 годзе шведскім хімікам Карлам Шэеле, аднак яго склад быў адкрыты толькі ў 1836 годзе, а сінтэз ажыццёўлены з ацэтону ў 1873 годзе Шарлем Фрыдэлем[26].
Знаходжанне ў прыродзе
[правіць | правіць зыходнік]
Спірты шырока распаўсюджаны ў прыродзе як у вольным выглядзе, так і ў складзе складаных эфіраў.
Метылавы спірт у невялікай колькасці змяшчаецца ў некаторых раслінах, напрыклад: баршчэўніку (Heracleum)[24].
Этылавы спірт з’яўляецца натуральным прадуктам анаэробнага закісання арганічных прадуктаў, якія змяшчаюць вугляводы, пад дзеяннем дражджэй роду Saccharomyces і бактэрый Zimomonas і часта ўтвараюцца ў пракіслых ягадах і садавіне. Пры гэтым вугляводы праз паслядоўнасць ферментатыўных рэакцый, названую гліколізам, ператвараюцца ў піруват, які далей пад дзеяннем піруватдэкарбаксілазы пераходзіць у ацэтальдэгід. Апошні затым у прысутнасці алкагольдэгідрагеназы акцэптуе аднаўленчы эквівалент ад адноўленай формы NAD (аднаўленне NAD адбываецца на адной са стадый гліколізу), што дае этанол як канчатковы прадукт. Гэты працэс не толькі з’яўляецца прычынай назапашвання этанолу ў прыродных аб’ектах, але і актыўна выкарыстоўваецца ў вінаробстве, піваварстве і пякарнай прамысловасці[27]. Падчас закісання могуць утварацца таксама і іншыя спірты, напрыклад, ізапрапанол[28], бутанол-1[29], бутандыёл-2,3[30].
У эфірных алеях зялёных частак многіх раслін змяшчаецца (Z)-гексен-3-ол-1 («спірт лісцяў»), які надае ім характэрны пах[31]. Таксама ў раслінным свеце вельмі шырока прадстаўлены тэрпенавыя спірты, многія з якіх з’яўляюцца пахучымі рэчывамі, напрыклад: барнеол (складнік драўніны барнеакамфорнага дрэва), ментол (у мяце, герані)[32], гераніол[33] і цытранелол[34] (складнікі кветкавых эфірных алеяў), фенхол (у смале іглічных дрэў і пладах фенхелю) і іншыя.
У жывёльным і раслінным свеце пашыраны кандэнсаваныя тэтрацыклічныя спірты (вытворныя ганану), якія маюць высокую біялагічную актыўнасць і ўваходзяць у клас стэроідаў, напрыклад, халестэрын, які змяшчаецца ў клетках практычна ўсіх жывых арганізмаў, асабліва жывёл[35]. Асобную групу стэроідаў складаюць жоўцевыя шмататамныя спірты, якія знаходзяцца ў жоўці жывёл і чалавека: буфол, халестантэтрол, халестанпентол, міксінол, сцімнол, хімерол і іншыя[36].
У прыродзе сустракаюцца разнастайныя спіртавыя вытворныя вугляводаў, напрыклад, сарбіт (змяшчаецца ў ягадах вішні і рабіны)[37], маніт (у ясені)[38] і іншыя.
У 1959 годзе нямецкім хімікам Адольфам Бутэнантам пры вывучэнні экстракту самкі тутавага шаўкапрада быў адкрыты палавы атрактант, названы бамбіколам[39]. Далейшае вывучэнне ферамонаў казурак паказала, што значная частка гэтых ферамонаў прадстаўлена спіртамі[39].
Метабалізм спіртоў у арганізме чалавека
[правіць | правіць зыходнік]Фізіялагічная роля спіртоў
[правіць | правіць зыходнік]
Многія спірты з’яўляюцца ўдзельнікамі важных біяхімічных працэсаў, якія адбываюцца ў жывым арганізме. Так, некаторыя вітаміны адносяцца да класу спіртоў, напрыклад, вітамін А (рэтынол)[41], вітамін D (эргакальцыферол і іншыя)[42]. Стэроідныя гармоны, сярод якіх ёсць і спірты (эстрадыёл, картызол і іншыя), удзельнічаюць у рэгуляцыі абмену рэчываў і некаторых фізіялагічных функцыях арганізма[43].
Гліцэрына з’яўляецца асновай больш чым паловы прыродных ліпідаў, якія ўяўляюць сабой яе складаныя эфіры з тлустымі кіслотамі і з’яўляюцца крыніцамі энергіі для арганізма[44]. Таксама гліцэрына ўдзельнічае ў глюканеагенезе — працэсе ўтварэння глюкозы ў печані. Пры гэтым гліцэрына пад дзеяннем ферментаў ператвараецца ў гліцэральдэгід-3-фасфат, які далей трапляе ў метабалічны шлях глюканеагенезу[45]. Фізіялагічна важным паліолам з’яўляецца міа-іназітол.
Сярод ніжэйшых спіртоў з пункту гледжання фізіялогіі найбольшую цікавасць уяўляе, несумненна, этанол. У арганізме чалавека этанол з’яўляецца натуральным метабалітам і ў норме прысутнічае ў крыві ў вельмі нізкіх канцэнтрацыях. Таксама этанол можа паступаць у арганізм з ежай. Этанол у арганізме чалавека метабалізуецца пераважна ў печані. Пад дзеяннем цытазольнага ферменту алкагальдэгідрагеназы этанол акісляецца ў ацэтальдэгід, які далей перапрацоўваецца мітахандрыяльнай альдэгіддэгідрагеназай у ацэтат. Ацэтат пасля актывацыі караткаланцужковай ацыл-каэнзім А-сінтэтазай можа далей разбурацца ў цыкле Крэбса[46]. Ва ўтылізацыі этанолу другарадную ролю іграе таксама мікрасамальная этанол-акісляльная сістэма, прадстаўленая цытахромам P450 і каталазай[40]. Пры высокім змесце алкаголю ў крыві ферменты не спраўляюцца з акісленнем ацэтальдэгіду да ацэтату, і ў арганізме адбываецца назапашванне ацэтальдэгіду, які ў 10-30 разоў таксічней за этанол[47], за кошт чаго адбываецца атручванне арганізма, т. з. пахмелле. Па энергетычнай каштоўнасці для арганізма этанол (7 ккал/г) займае прамежкавае становішча паміж вугляводамі (4,1 ккал/г) і тлушчамі (9,3 ккал/г). Уклад этанолу ў агульную каларыйнасць ежы ў не хворых на алкагалізм дарослых людзей можа дасягаць 12 %. Аднак спажыванне этанолу як харчовы прадукт і крыніца энергіі мае шэраг недахопаў з біяхімічнага пункта гледжання. Акрамя ўтварэння таксічнага ацэтальдэгіду, да такіх заган варта прылічыць той факт, што залішнія калорыі, якія паступілі ў арганізм у форме этанолу, могуць запасіцца толькі ў тлушчах, бо магчымасць пераўтварэння этанолу ў вугляводы ў арганізме чалавека адсутнічае[46]. Апроч таго, этанол парушае іншыя метабалічныя працэсы: інгібіруе глюканеагенез (гэта з’яўляецца прычынай гіпаглікеміі пры ўжыванні вялікіх доз алкаголю), паскарае вытворчасць цытакінаў, змяняе канцэнтрацыю гармонаў[48]. Алкагольныя напоі змяшчаюць вельмі мала вітамінаў і мінеральных рэчываў, што таксама можа аказаць негатыўны ўплыў на здароўе. Таксама харчовы этанол сам па сабе нашмат даражэйшы за энергетычна эквівалентную колькасць цукру[46].
Таксічнасць спіртоў
[правіць | правіць зыходнік]Аднаатамныя гранічныя спірты ўводзяць арганізм у нарказападобнае стан, а таксама праяўляць таксічнае дзеянне[49].
Метылавы спірт — моцны яд (асабліва пры ўжыванні ўнутр) нервовага і сардэчна-сасудзістага дзеяння з выяўленым кумулятыўным эфектам; пашкоджвае органы зроку аж да поўнай слепаты. У вялікіх дозах (30 г і больш) прыводзіць да смерці[50].
Этылавы спірт валодае таксічным эфектам. Хутка ўсмоктваецца праз слізістую абалонку страўніка і тонкага кішэчніка, дасягаючы максімальнага засяроджвання ў крыві праз 60-90 хвілін пасля ягонага ўжывання[51]. Этанол выклікае спачатку ўзбуджэнне, а затым рэзкае прыгнечанне цэнтральнай нервовай сістэмы (у тым ліку разбурае мазгавую абалонку); ягонае ўжыванне прыводзіць да парушэння найважнейшых функцый арганізма, цяжкага пашкоджання органаў і сістэм. Аказвае эмбрыятаксічнае і тэратагеннае дзеянні.
Ізапрапілавы спірт па сваім таксічным уздзеянні нагадвае этанол, выклікаючы прыгнечанне цэнтральнай нервовай сістэмы і пашкоджваючы ўнутраныя органы. У высокай канцэнтрацыі прыводзіць да комы, канвульсій і смяротнага зыходу (каля 3—4 г/кг)[52].
У сувязі з шырокім выкарыстаннем найпрасцейшых спіртоў у розных галінах прамысловасці і, у прыватнасці, як растваральнікі, небяспечным з’яўляецца іхняе інгаляцыйнае ўздзеянне. Вострае таксічнае ўздзеянне спіртоў, выпрабаванае на пацуках, выявілася ў наступных інгаляцыйных канцэнтрацыях:
- метылавы спірт: 3,16 % на працягу 18-21 гадзін — 100 % лятальнасць; 2,25 % на працягу 8 гадзін — наркатычны эфект; 0,8 % на працягу 8 гадзін — летаргія;
- этылавы спірт: 3,2 % на працягу 8 гадзін — частковая лятальнасць; 2,2 % на працягу 8 гадзін — глыбокі наркоз; 0,64 % на працягу 8 гадзін — летаргія;
- ізапрапілавы спірт: 1,2 % на працягу 8 гадзін — 50 % лятальнасць; 1,2 % на працягу 4 гадзін — наркатычны эфект[53].
Этыленгліколь вельмі таксічны пры пераральным трапленні ў арганізм, пашкоджвае ЦНС і ныркі. Смяротная доза складае 1,4 г/кг масы цела[54].
Фізічныя ўласцівасці і будова спіртоў
[правіць | правіць зыходнік]

Малекулы спіртоў, падобна малекуле вады, маюць кутнюю будову. Кут R−O−H у малекуле метанолу роўны 108,5°[55]. Атам кіслароду гідраксільнай групы знаходзіцца ў стане sp³-гібрыдызацыі. Спірты маюць істотна больш высокія тэмпературы плаўлення і кіпення, чым можна было б меркаваць на падставе фізічных уласцівасцей роднасных злучэнняў. Так, з рада маназамешчаных вытворных метану, метанол мае незвычайна высокую тэмпературу кіпення, не зважаючы на адносна невялікую малекулярную масу[56]:
Малекулярныя масы і тэмпературы кіпення метану і некаторых ягоных вытворных[57]
| Метан CH4 |
Метанол CH3OH |
Хларметан CH3Cl |
Нітраметан CH3NO2 |
Брамметан CH3Br | |
|---|---|---|---|---|---|
| Малярная маса, г/моль | 16,04 | 32,04 | 50,48 | 61,04 | 94,94 |
| Тэмпература кіпення, °С | −161,5 | 64,5 | −24,2 | 101,2 | 3,6 |
Высокія тэмпературы кіпення спіртоў тлумачацца наяўнасцю міжмалекулярных вадародных сувязей[55]. Энергія вадароднай сувязі значна ніжэйшая за энергію кавалентнай хімічнай сувязі. Так, напрыклад, для метанолу энергія вадароднай сувязі складае 16,7 кДж/моль[58], тады як сувязі C−H, C−O і O−H маюць энергію 391,7, 383,5 і 428,8 кДж/моль адпаведна[59]. Тым не менш, уплыў вадародных сувязей на фізічныя ўласцівасці спіртоў вельмі значны.
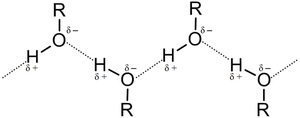
Малекулы спірту, маючы дзве палярныя сувязі C−O і O−H, маюць дыпольны момант (~5,3—6,0×10−30 Кл·м)[55]. Электрастатычныя зарады ў малекуле метанолу складаюць: на атаме вугляроду 0,297 e; на атаме гідраксільнага вадароду 0,431 e; на атаме кіслароду −0,728 e[60]. Разам з тым, энергія іанізацыі спіртоў ніжэй, чым у вады (10,88 эВ для метанолу супраць 12,61 эВ для вады)[61], што тлумачыцца электронадонарным эфектам алкільнай групы.
Уплыў гідраксільнай групы асабліва вяліка на злучэнні з невялікім вуглевадародным ланцужком. Так, напрыклад, метанол і этанол неабмежавана змешваюцца з вадой і маюць даволі высокія шчыльнасці і тэмпературы кіпення для сваёй малекулярнай масы, у той час як вышэйшыя спірты гідрафобныя і мала адрозніваюцца па ўласцівасцях ад адпаведных вуглевадародаў[62].
Атрыманне спіртоў
[правіць | правіць зыходнік]Агульныя хімічныя метады атрымання спіртоў
[правіць | правіць зыходнік]Спірты могуць быць атрыманы з самых розных класаў злучэнняў, такіх як вуглевадароды, галагеналканы, аміны, карбанільныя злучэнні, эпаксіды. Галоўным чынам, усе метады зводзяцца да рэакцый акіслення, аднаўлення, далучэння і замяшчэння.
Спірты атрымліваюць, акісляючы алканы і цыклаалканы пад дзеяннем моцных неарганічных акісляльнікаў: азону, перманганата калію, аксіду хрому (VI), хромавай кіслаты, дыяксіду селену, пераксіду вадароду, а таксама некаторых надкіслот. Праз магчымасць далейшага акіслення атрымоўваных спіртоў, метад мае значэнне толькі для атрымання троесных спіртоў[65].
Акісленне алкенаў значна больш распаўсюджана ў лабараторнай практыцы, асабліва для атрымання двухатамных спіртоў — дыёлаў. У залежнасці ад выбару рэагенту акісленне можна правесці з рознай стерэаселектыўнасцю: пры дзеянні на алкены тэтрааксіду осмію, перманганату калію, хларату натрыю, ёду з карбаксілатам срэбра працякае сін-гідраксілаванне; для правядзення анты-гідраксілавання выкарыстоўваюць пераксід вадароду і надкіслоты, аксіды малібдэну (VI) і вальфраму (VI), аксід селену (IV) і іншыя[66].
Спірты ўтвараюцца таксама пры аднаўленні альдэгідаў або кетонаў пад дзеяннем барагідрыду натрыю ў пратонным растваральніку, а таксама алюмагідрыду літыю. Аднаўленне складаных эфіраў і карбонавых кіслот таксама вырабляецца пад дзеяннем комплексных гідрыдаў, як правіла, алюмагідрыду літыю і прыводзіць да спіртоў[67].
Кіслотна-каталізаванае далучэнне вады да алкенаў прыводзіць да ўтварэння спіртоў. У адпаведнасці з правілам Маркоўнікава, у гэтай рэакцыі ўтвараюцца больш замешчаныя спірты. У лабараторнай практыцы часцей выкарыстоўваюць тоесную, але больш мяккую рэакцыю аксімеркуравання — дэмеркуравання, а таксама рэакцыю гідрабаравання — акіслення, якая прыводзіць да прадуктаў, якія не адпавядаюць правілам Маркоўнікава[68].
Рэакцыі нуклеафільнага далучэння металарганічных злучэнняў (ацэтыленідаў, рэактываў Грын’яра, медзь- і літыйарганічных злучэнняў і г. д.) да карбанільных злучэнняў таксама прыводзяць да спіртоў, прычым калі далучэнне адбываецца да фармальдэгіду HCHO, то ўтвараюцца першасныя спірты, калі да іншых альдэгідаў, то ўтвараюцца другасныя спірты. Далучэнне да кетонаў дае троесныя спірты. Троесныя спірты можна атрымаць таксама шляхам далучэння двух эквівалентаў металарганічнага злучэння да складаных эфіраў.
Спірты можна атрымліваць пры апрацоўцы галагенаалканаў растворам шчолачы. Рэакцыя працякае як нуклеафільнае замяшчэнне і суправаджаецца рацэмізацыяй (пры манамалекулярным механізме) або адварочваннем канфігурацыі (пры бімалекулярным механізме). Важным прэпаратыўным метадам з’яўляецца акісленне алкілгалагенідаў надпераксідам калію[69].
Прамысловыя метады атрымання спіртоў
[правіць | правіць зыходнік]У прамысловасці спірты атрымліваюць з дапамогай хімічных, альбо біяхімічных метадаў вытворчасці.
Адзіным прамыслова важным метадам сінтэзу метанолу з’яўляецца каталітычная рэакцыя паміж аксідам вугляроду (II) і вадародам. Сыравінай у вытворчасці метанолу служыць прыродны газ, які на першай стадыі працэсу падвяргаюць ачыстцы ад злучэнняў серы (сера з’яўляецца ядам для каталізатараў, выкарыстоўваных на наступнай стадыі). Далей адбываецца паравая канверсія прыроднага газу ў сінтэз-газ (сумесь СО і вадароду), які пасля кандэнсацыі пары вады ператвараюць у метанол на змяшаным медна-цынка-хромавым каталізатары пры тэмпературы 250 °C і ціску да 10 МПа. Атрыманы такім чынам метанол змяшчае ваду і прымешкі іншых спіртоў (этанолу, прапанолу і вышэйшых) і можа быць ачышчаны рэктыфікацыяй. Сусветнае спажыванне метанолу ў 2015 годзе склала каля 70 млн тон[70].
Этанол і прапанол-2 атрымліваюць метадам гідратацыі адпаведных алкенаў — этылену і прапілену. У прамысловасці выкарыстоўваюць два варыянты гідратацыі: сернакіслотную і каталітычную. Сернакіслотная гідратацыя ўключае ў сябе абсорбцыю этылену канцэнтраванай сернай кіслатой (94—98 %) пры тэмпературы 80 °C і ціску 1,3—1,5 МПа і далейшы гідроліз утвораных сульфаэфіраў вадой. Другі метад гідратацыі заснаваны на выкарыстанні фосфарнай кіслаты, нанесенай на сілікагель або іншую падкладку, як каталізатар. Сумесь дэіянізаванай вады і этылену награваюць да тэмпературы 300 °C пад ціскам 6—8 МПа, а атрыманы этанол чысцяць рэктыфікацыяй. Гэтыя метады дазваляюць атрымаць этанол, які змяшчае 5 % вады па масе. Атрыманне бязводнага этанолу (99,9 %) заснавана на азеатропным выдаленні вады з бензолам[71]. Па даных на 2003 год, сусветная вытворчасць этанолу толькі гідратацыяй этылену складае 6 млн тон у год[72].
Сусветная вытворчасць паліўнага этанолу ў 2015 годзе па даных Renewable Fuel Association склала каля 77 млн тон[73].
Для гідратацыі прапілену патрабуюцца мякчэйшыя ўмовы. Сернакіслотны працэс праводзяць пры пакаёвай тэмпературы і канцэнтрацыі сернай кіслаты, роўнай 70—75 %, а каталітычная гідратацыя працякае пры 180 °C і 4 МПа. Часам для гідратацыі прапілену выкарыстоўваюць вальфрамавы каталізатар (WO3·SiO2, 250 °C і 25 МПа)). Сусветная вытворчасць прапанолу-2 у 2008 годзе складала 1,8 млн тон[74][75][76][77].
Таксама рэакцыяй гідратацыі ў прамысловасці атрымліваюць этыленгліколь — адзін з найважнейшых прадуктаў хімічнай прамысловасці, які вырабляецца ў колькасці 19,9 млн тон штогод[78] і выкарыстоўваны ў вялікіх колькасцях для вытворчасці антыфрызу і валокнаў. Сыравінай для гэтага сінтэзу служыць вокіс этылену, атрымоўваны прамым акісленнем этылену кіслародам паветра. Ператварэнне вокісу этылену ў этыленгліколь адбываецца пры награванні яе сумесі з 20-кратным мольным лішкам вады да 200 °C без каталізатара. Этыленгліколь затым адлучаецца ад вады і прадуктаў алігамерызацыі ў выніку паслядоўных рэктыфікацый[79].
Прамысловае атрыманне прапанолу-1 заснавана на рэакцыі гідрафармілавання этылену і далейшым гідрыраванні атрыманага прапаналю. Гідрафарміляванне праводзіцца пры тэмпературы 90—130 °C, агульным ціску прапілену, аксіду вугляроду(II) і вадароду, роўным 2,8 МПа, і ў прысутнасці 500 мч родыевага каталізатара. Другая стадыя працякае пры 110—150 °C у лішку вадароду на розных металічных каталізатарах (выкарыстоўваюцца камбінацыі злучэнняў медзі, цынку, нікелю і хрому)[74]. Аб’ёмы сусветнай вытворчасці прапанолу-1 на 2003 год склалі 0,14 млн тон[80].
Гліцэрыну атрымліваюць як пабочны прадукт ператварэння тлушчаў у тлустыя кіслоты і метылавыя эфіры тлустых кіслот. Гэты працэс ляжыць у аснове атрымання біядызелю, пры гэтым на кожную тону біядызелю ўтвараецца 100 кг гліцэрыны. Такім метадам сінтэзуюць 1,5 млн тон гліцэрыны штогод (2004 год), прычым, паводле прагнозаў, гэтыя аб’ёмы будуць расці ў сувязі з павелічэннем цікавасці да альтэрнатыўных відаў паліва. Тлушчы гідролізуюць пры 220—260 ° C і ціску 2—6 МПа, альбо пераэтэрыфікуюць метанолам. Расшчапленне тлушчаў пад дзеяннем шчолачы або карбанатаў ужываецца ў абмежаваным маштабе, напрыклад, пры вытворчасці мыла[81][82][83].
Вышэйшыя тлустыя спірты вырабляюць некалькімі спосабамі, сярод якіх гідрагеналіз метылавых эфіраў тлустых кіслот, атрымоўваных пераэтэрыфікацыяй тлушчаў, а таксама гідрафармілаванне алкенаў і алігамерызацыя этылену з наступным акісленнем (метад Цыглера). Штогод у свеце вырабляецца 2,15 млн тон вышэйшых тлустых спіртоў (2003 год)[84][85].
Для некаторых спіртоў важнейшую ролю ў прамысловым сінтэзе іграюць біяхімічныя метады. У прыватнасці, аб’ёмы вырабленага біяэтанолу значна перавышаюць аб’ёмы сінтэтычнага этанолу. У аснове біяхімічнага атрымання этанолу ляжыць кіслотны або ферментатыўны гідроліз расліннай сыравіны з наступнай анаэробнай спіртавой ферментацыяй (зброджваннем) утвараных вугляводаў дражджавымі грыбамі (Saccharomyces) або некаторымі відамі бактэрый. У прыватнасці, дрожджы з’яўляюцца вельмі зручнымі мікраарганізмамі для шырокага прамысловага выкарыстання. Ферментацыя пад дзеяннем дражджэй вызначаецца высокай селектыўнасцю, нізкім назапашваннем пабочных прадуктаў, высокім выхадам этанолу, высокай хуткасцю працэсу, добрай талерантнасцю дражджэй да павышаных канцэнтрацый этанолу і субстрату. Сыравінай у гэтым працэсе могуць служыць лёгка ферментаваныя вугляводы, а таксама крухмал і іншыя арганічныя субстраты, якія неабходна папярэдне гідралізаваць до ферментаванай формы. Звычайна выкарыстоўваюць сельскагаспадарчыя культуры (цукровы бурак, бульба, збожжавыя культуры), прадукты лясной гаспадаркі (драўніна, салома), альбо сельскагаспадарчыя адходы[86].
Вытворчасць біябутанолу заснавана на ферментацыі вугляводнай сыравіны з выкарыстаннем бактэрый Clostridium acetobutylicum[87].
Хімічныя ўласцівасці спіртоў
[правіць | правіць зыходнік]Хімічныя ўласцівасці спіртоў вызначаюцца наяўнасцю ў іх гідраксільнай групы. Паколькі гідраксільная група з’яўляецца палярнай, яна можа гетэралітычна дысацыяваць, асабліва, пад дзеяннем моцных асноў. Такім чынам, спірты праяўляюць уласцівасці слабых кіслот. Акрамя таго, высокая электраадмоўнасць кіслароду абумоўлівае наяўнасць электрафільнага атама вугляроду і, адпаведна, здольнасць спіртоў падвяргацца рэакцыям нуклеафільнага замяшчэння пад дзеяннем рада нуклеафілаў. Нарэшце, атам кіслароду гідраксільнай групы мае нуклеафільны характар, таму спірты могуць выступаць нуклеафіламі ў рэакцыях замяшчэння і далучэння. Таксама для спіртоў уласцівыя рэакцыі акіслення.
Дысацыяцыя і кіслотна-асноўныя ўласцівасці спіртоў
[правіць | правіць зыходнік]Кіслотныя ўласцівасці спіртоў
[правіць | правіць зыходнік]Спірты здольныя праяўляць як кіслотныя, так і асноўныя ўласцівасці. Як слабыя кіслоты, спірты дысацыююць па сувязі O−H з утварэннем алкаксід-іона. Дысацыяцыя вельмі слабая — настолькі, што яны не лічацца электралітамі і не праводзяць электрычны ток. Кіслотныя характарыстыкі спіртоў ацэньваюць паводле канстанты кіслотнасці Ka.
У водным растворы кіслотнасць спіртоў зніжаецца з павелічэннем малекулярнай масы і разгалінаванасці вуглевадароднага ланцуга. Гэта звязваюць з павелічэннем станоўчага індуктыўнага эфекту алкільных замяшчальнікаў у гэтым радзе і памяншэннем устойлівасці ўтворанага алкаксід-іона за кошт лакалізацыі адмоўнага зарада на атаме кіслароду[88].
У цэлым, электронаакцэптарныя замяшчальнікі (−NO2, −CN, −F, −Cl, −Br, −I, −OR і іншыя) павялічваюць кіслотнасць спіртоў (памяншаюць pKa). Наадварот, электронадонарныя замяшчальнікі (напрыклад, алкільныя замяшчальнікі) памяншаюць кіслотнасць спіртоў (павялічваюць pKa). Так, pKa 2,2,2-трыфтарэтанолу мае значэнне 12,43 (супраць 15,9 у этанолу), а поўнасцю фтарыраванага трэт-бутанолу — 5,4 (супраць 17,7 у трэт-бутанолу)[89]. Параўнальная кіслотнасць спіртоў і злучэнняў іншых класаў схематычна прадстаўлена на малюнку[90].
Як слабыя кіслоты, спірты ўступаюць у рэакцыі з шчолачнымі, шчолачназямельнымі і некаторымі іншымі металамі, і з моцнымі асновамі, напрыклад, гідрыдамі або амідамі металаў, рэактывамі Грын’яра[91].
Уласцівасці асноў у спіртоў
[правіць | правіць зыходнік]Спірты могуць таксама паводзіць сябе як слабыя асновы Люіса, утвараючы з моцнымі мінеральнымі кіслотамі солі алкаксонію, а таксама даючы донарна-акцэптарныя комплексы з кіслотамі Люіса. Звычайна падобныя рэакцыі не спыняюцца на зазначанай стадыі і вядуць да нуклеафільнага замяшчэння гідраксільнай групы або адшчаплення вады.
Колькасна асноўнасць спіртоў ацэньваюць паводле канстанты асноўнасці pKb або звязанай з ёй канстанты кіслотнасці спалучанай кіслаты pKaH+:
Спірты з’яўляюцца слабымі асновамі, і іхняя асноўнасць узрастае з павелічэннем даўжыні ці разгалінаванасці вуглевадароднага радыкала пры гідраксільнай групе. Гэты эфект назіраецца праз рост станоўчага індуктыўнага эфекту радыкала ў гэтым радзе, за кошт якога павялічваецца адмоўны зарад на атаме кіслароду гідраксільнай групы[92].
Нуклеафільнае замяшчэнне
[правіць | правіць зыходнік]Атам вугляроду, непасрэдна злучаны з гідраксільнай групай, мае частковы дадатны зарад, што робіць магчымай атаку нуклеафільнай часціцы (галагенід-іона, аміяку, спірту і іншых) па гэтым атаме вугляроду з замяшчэннем гідраксільнай групы на гэту часціцу. Гідраксільная група з’яўляецца дрэннай адыходнай групай, таму звычайна неабходна яе дадатковая актывацыя.
- Рэакцыі нуклеафільнага замяшчэння ў спіртах лягчэй працякаюць у кіслым асяроддзі, паколькі гідраксільная група спірту пратаніруецца, і фактычнай адыходнай часціцай з’яўляецца не гідраксід-іон OH−, а малекула вады H2O. Кіслотныя ўласцівасці можа мець сам рэагент (часта выкарыстоўваюць галагенавадародныя кіслоты), так і спецыяльна дададзеная неарганічная кіслата, напрыклад, серная кіслата[93].
- Замяшчэнне гідраксільнай групы таксама працякае пад дзеяннем галагенідаў серы і фосфару (SOCl2, PBr3, PBr5, POCl3 і іншыя). У такім разе ключавую ролю выконвае злучэнне серы ці фосфару, утваральнае актываваны інтэрмедыят з малекулай спірту[94].
- Гідраксільную групу таксама ператвараюць у сульфанатную групу, якая з’яўляецца добрай адыходнай групай. Для гэтых мэт спірт спачатку ператвараюць у сульфанат, які затым падвяргаюць рэакцыі нуклеафільнага замяшчэння. Як рэагенты для мадыфікацыі гідраксільнай групы звычайна выкарыстоўваюць метансульфанілхларыд або п-талуалсульфанілхларыд[95].
Дэгідратацыя
[правіць | правіць зыходнік]У прысутнасці кіслотных каталізатараў (аксід алюмінію, серная кіслата, фосфарная кіслата і іншыя) спірты могуць падвяргацца дэгідратаціі з утварэннем алкенаў. Напрыклад, дэгідратацыя этылавага спірту прыводзіць да ўтварэння этылену. Рэакцыя працякае ў адпаведнасці з правілам Зайцава, паводле якога пры дэгідратаціі ўтвараецца больш устойлівы, больш замешчаны пры падвойнай сувязі алкен[96].
Акісленне
[правіць | правіць зыходнік]- Пад дзеяннем розных акісляльнікаў першасныя спірты акісляюцца да альдэгідаў і далей — да карбонавых кіслот, прычым спыніць рэакцыю на стадыі ўтварэння альдэгідаў, прадухіліўшы іхняе далейшае акісленне, атрымоўваецца толькі за кошт выкарыстання спецыяльных рэагентаў (хлархрамату пірыдынію PCC і дыхрамату пірыдынію PDC).
- Другасныя спірты акісляюцца да кетонаў. Рэакцыю звычайна праводзяць пад дзеяннем рэагента Джонса (CrO3—серная кіслата). Далейшае акісленне кетонаў працякае толькі ў жорсткіх умовах з разбурэннем вугляроднага шкілета.
- Троесныя спірты акісляюцца толькі ў вельмі жорсткіх умовах з разбурэннем вугляроднага шкілета[97].
Ідэнтыфікацыя спіртоў
[правіць | правіць зыходнік]Хімічныя метады ідэнтыфікацыі спіртоў
[правіць | правіць зыходнік]Якасны аналіз гідраксільных груп
[правіць | правіць зыходнік]
Наяўнасць гідраксільнай групы ў злучэнні можна выявіць некалькімі распаўсюджанымі хімічнымі рэакцыямі.
- Проба Лукаса заключаецца ў дзеянні на спірт сумесі салянай кіслаты і хларыду цынку. Пры гэтым адбываецца ўтварэнне алкілхларыду, які спачатку ўтварае эмульсію са спіртам, а затым адслойваецца ў выглядзе другой фазы. Проба дазваляе адрозніць спірты з рознай будовай вугляроднага ланцуга: троесныя спірты рэагуюць практычна імгненна, другасныя — прыкладна праз 5 хвілін, а першасныя рэагуюць вельмі павольна. Некаторыя першасныя спірты, актыўныя ў рэакцыях нуклеафільнага замяшчэння (алілавы, бензілавы), таксама даюць станоўчую рэакцыю з рэактывам Лукаса[98].
- Ёдаформная проба прызначана для ідэнтыфікацыі метылкетонаў і метылкарбінолаў (RCH (OH)СH3) па рэакцыі з ёдам у шчолачным асяроддзі. Пры гэтым адбываецца ўтварэнне жаўтаватага асадку ёдаформу, які мае характэрны пах[99].
- Проба Мэера дазваляе дыферэнцаваць першасныя, другасныя і троесныя спірты паводле рэакцыі атрымоўваных з іх нітравытворных з азоцістай кіслатой. На першай стадыі спірты ператвараюць у галагенавытворныя, а затым — у нітраалканы. Пры ўзаемадзеянні нітразлучэнняў з HNO2 раствор набывае чырвоную афарбоўку пры падшчалочванні, калі зыходны спірт быў першасным; раствор у хлараформе становіцца сінім, калі спірт быў другасным. Троесныя спірты даюць адмоўную рэакцыю (бясколерны раствор)[100].
- Цэратная проба заключаецца ва ўзаемадзеянні спіртоў з азотнакіслым растворам гексанітратацэрату (IV) амонію, што мае жоўтую афарбоўку. Пры гэтым утвараюцца пераходныя комплексы чырвонага колеру, якія затым абескаляроўваюцца з прычыны акіслення спірту і пераходу Ce (IV) ў Ce (III)[101].
- Акісляльная проба: пры ўзаемадзеянні першасных або другасных спіртоў з рэактывам Джонса, мелы аранжавую афарбоўку, утвараюцца прадукты акіслення, а сам рэактыў змяняе колер на зялёны або блакітны, дзякуючы солям адноўленага хрому (III). Важнай асаблівасцю тэсту з’яўляецца час фіксацыі змены афарбоўкі — 2 секунды, па заканчэнні якога любыя далейшыя змены ў структуры або колеры раствору не прымаюцца да ўвагі[101].
Колькасны аналіз спіртоў
[правіць | правіць зыходнік]Для колькаснага аналізу спіртоў звычайна выкарыстоўваюць метады, заснаваныя на рэакцыі этэрыфікацыі ангідрыдамі карбонавых кіслот, напрыклад, воцатным, фталевым, а таксама пірамелітавым дыангідрыдам. Змест спірту вызначаецца тытраваннем гідраксідам натрыю кіслаты, якая ўтвараецца ў выніку рэакцыі[102].
Іншы метад аналізу заключаецца ў вызначэнні колькасці гідраксільных груп, здольных рэагаваць з метылмагнійёдыдам. У гэтым выпадку разлік вядуць паводле колькасці вылучанага метану (метад Чугаева — Цэрэвіцінава).
Для гліколяў прымяняецца акісляльна-аднаўленчы метад, дзе як акісляльнік выкарыстоўваецца ёдная кіслата. Аналіз праводзяць паводле рэакцыі ўтворанай ёднаватай кіслаты HIO3 з ёдыдам калію і наступным тытраваннем вылучанага ёду тыясульфатам натрыю[102].
Спектральныя метады аналізу спіртоў
[правіць | правіць зыходнік]Мас-спектраметрычныя метады аналізу спіртоў
[правіць | правіць зыходнік]Мас-спектры аліфатычных спіртоў маюць слабыя пікі малекулярнага іона, а для вышэйшых і разгалінаваных спіртоў гэтыя пікі практычна адсутнічаюць, паколькі ў істотнай ступені адбываецца фрагментацыя малекулы. Фрагментацыя, як правіла, звязана са стратай малекулы вады, а таксама элімінаванням этылену. Для даўгаланцужковых спіртоў пераважае адшчапленне вады, таму іхнія мас-спектры падобныя на мас-спектры алкенаў. Для першасных спіртоў назіраюцца пікі m/z 31, для другасных — m/z 45, 59, 73, …, для троесных — m/z 59, 73, 87, …[103].
ІК-спектраскапічныя метады аналізу спіртоў
[правіць | правіць зыходнік]ІК-спектры спіртоў вызначаюцца двума тыпамі інтэнсіўных характарыстычных палос паглынання:
- палосы паглынання, звязаныя з валентнымі хістаннямі сувязі O−H: 3650—3200 см−1;
- палосы паглынання, звязаныя з валентнымі хістаннямі сувязі С−O: 1210—1000 см−1.
Таксама вылучаюць палосы паглынання сярэдняй інтэнсіўнасці, як правіла, не мелыя вызначальнага значэння: у дыяпазоне 1450—1250 см−1 (плоскасныя дэфармацыйныя хістанні O−H) і 750—650 см−1 (пазаплоскасныя дэфармацыйныя хістанні O−H)[104].
Характарыстычныя палосы паглынання спіртоў у інфрачырвонай вобласці[104]
| Тыпы сувязяў і хістанні | Дыяпазон, см−1 | Апісанне паласы паглынання |
|---|---|---|
| O−H, валентныя хістанні | ||
| ROH, неасацыіраваныяас | 3650—3580 | Вузкая паласа, назіраная ў разведзеных растворах або парах |
| ROH···HOR, дымеры (вадародная сувязь) | 3550—3400 | Шырокая паласа, якая губляе інтэнсіўнасць пры развядзенні |
| ROH···HOR···, палімеры | 3400—3200 | Шырокая паласа або шэраг палос |
| С−O, валентныя хістанні | ||
| R3COH, троесныя спірты | 1210—1100 | Палосы высокай інтэнсіўнасці, якая памяншаецца пры развядзенні |
| R2CHOH, другасныя спірты | 1125—1000 | |
| RCH2OH, першасныя спірты | 1075—1000 | |
| O−H, дэфармацыйныя хістанні | ||
| ROH | 1450—1250 750—650 |
Шырокія палосы сярэдняй інтэнсіўнасці, якія не маюць практычнага значэння |
ЯМР-спектраскапічныя метады аналізу спіртоў
[правіць | правіць зыходнік]ЯМР-спектраскапія ядраў 1H шырока выкарыстоўваюцца для аналізу спіртоў, аднак на велічыні хімічных зрухаў пратонаў гідраксільнай групы (δ, м. д.) істотна ўплывае прырода растваральніку і іншыя вонкавыя фактары. Для аліфатычных і аліцыклічных спіртоў δ складае 0,5—3,0 (у ДМСА-d6: 4—6)[105].
Таксама для вывучэння спіртоў ужываюць спектраскапію на ядрах 17O. Значная розніца ў зрухах для першасных (этанол: δ 5,9 м д.), другасных (прапанол-2: δ 39,8 м д.) і троесных спіртоў (2-метылпрапанол-2: δ 62,3 м д.) адносна вады H217O дазваляе ўстанавіць або пацвердзіць структуру доследнага злучэння[106].
-
Спектр 1H ЯМР этанолу
-
ІК-спектр этанолу
Выкарыстанне спіртоў
[правіць | правіць зыходнік]Эканамічнае значэнне
[правіць | правіць зыходнік]Вобласці выкарыстання спіртоў шматлікія і разнастайныя, асабліва ўлічваючы найшырэйшы спектр злучэнняў, якія адносяцца да гэтага класа. Разам з тым, з прамысловага пункту гледжання, толькі невялікі шэраг спіртоў уносіць прыкметны ўклад у глабальную сусветную эканоміку.
У TOP 50 за 2002 год злучэнняў[К 3], якія выпускаюцца хімічнай прамысловасцю ЗША, са спіртоў уваходзяць толькі метанол (14-е месца) і этыленгліколь (29-е месца)[107]. У наступныя 50 найважнейшых хімічных злучэнняў, паводле даных за 1999 год, уключаны ізапрапілавы спірт, н-бутылавы спірт, сінтэтычны этанол, прапіленгліколь, дыэтыленгліколь, 2-этылгексанол, бутандыёл-1,4, сарбіт і гліцэрына[108].
Найбольш распаўсюджаным і выкарыстоўваным спіртам у свеце з’яўляецца этанол. Ягоны сусветны аб’ём спажывання складае каля 65 млн тон[К 4]. Сукупны сусветны аб’ём спажывання іншых спіртоў (акрамя этанолу) па розных кірунках выкарыстання складае каля 70 млн тон (станам на 2009 год)[К 5].
Выкарыстанне ў арганічным сінтэзе
[правіць | правіць зыходнік]Асноўная частка метылавага спірту выкарыстоўваецца ў прамысловым сінтэзе фармальдэгіду метадам высокатэмпературнага каталітычнага акіслення метанолу[К 6][109]. Акрамя таго, з метанолу атрымліваюць трэт-бутылметылавы эфір, воцатную кіслату (працэс Мансанта)[110], N,N-дыметыланілін[111], метыламіны[112] і хларметан[113].
З этанолу ў прамысловасці вырабляюць дыэтылавы эфір (метадам дэгідратацыі пры 250 °C над Al2O3)[114], хлараль[115], ацэтальдэгід[116] і этылацэтат[117].
Ізапрапілавы спірт пры каталітычным вадкафазным дэгідрыраванні на нікелі Рэнея пры 150 °C ператвараюць у ацэтон[118]. Асноўным прадуктам, што атрымліваецца з бутанолу, з’яўляецца бутылакрылат[119].
Выкарыстанне як паліва
[правіць | правіць зыходнік]Для паліўных мэт сёння выкарыстоўваюцца ў прамысловых аб’ёмах тры спірты: метанол, этанол і бутанол-1, што звязана, перш за ўсё, з іхняй камерцыйнай даступнасцю і магчымасцю масавай вытворчасці з расліннай сыравіны (акрамя метанолу[К 7]). Пры гэтым магчыма выкарыстанне спіртоў у выглядзе паліва ў чыстым выглядзе, у выглядзе розных сумесяў з бензінам або дызельным палівам[120], а таксама як аксігенавальныя дабаўкі (до 10 %) дзеля павышэння актанавага ліку і зніжэння таксічнасці адпрацаваных газаў[К 8][121][122]. Асобным напрамкам з’яўляецца выкарыстанне метанолу для пераэтэрыфікацыі тлушчаў у вытворчасці біядызелю[123].
Пераважным паліўным спіртам з’яўляецца этанол. Паводле ацэнак экспертаў, на 2009 год 80-90 % усяго вырабленага ў свеце этылавага спірту было выкарыстана ў гэтых мэтах і склала 73,9 млрд літраў (≈ 58 млн тон)[124][125].
Асноўнымі прычынамі, якія паслужылі актыўнаму вывучэнню спіртоў як альтэрнатыўнае паліва, з’яўляюцца[126]:
- рост цэн на нафту і газ, а таксама вычэрпнасць гэтых рэсурсаў у будучыні;
- спірты маюць высокія эксплуатацыйныя якасці, а прадукты згарання ўтрымоўваюць менш шкодных рэчываў;
- спірты могуць вырабляцца біяхімічным метадам з адходаў харчовай, дрэваапрацоўчай і цэлюлозна-папяровай прамысловасці, што адначасна вырашае праблему ўтылізацыі.
Разам з тым, масавае выкарыстанне вышэйпаказаных спіртоў як маторнае паліва, акрамя чыста эканамічных прычын, мае шэраг недахопаў[127]:
- метанол і этанол маюць у параўнанні з бензінам меншую энергаэфектыўнасць і, адпаведна, забяспечваюць большы расход;
- нізкія тэмпературы кіпення спіртоў могуць служыць чыннікам утварэння паравых коркаў, што можа істотна ўскладніць працу рухавіка;
- гіграскапічнасць спіртоў, а таксама іхняя растваральнасць у вадзе можа прывесці да рэзкага зніжэння магутнасці пры трапленні вільгаці ў паліўную сістэму;
- спірты маюць істотна больш высокія каразійныя ўласцівасці ў параўнанні з вуглевадародамі;
- адносна высокая цеплата згарання метанолу і этанолу можа служыць прычынай праблемы пры змешванні гэтых спіртоў з паветрам і далейшай транспарціроўкі праз упускны калектар рухавіка.
Прамысловае выкарыстанне спіртоў
[правіць | правіць зыходнік]Растваральнікі
[правіць | правіць зыходнік]Сярод растваральнікаў шырокі распаўсюд маюць самыя розныя тыпы спіртоў: аднаатамныя (метанол, прапанол-2) і шмататамныя (этыленгліколь, гліцэрына); аліфатычныя (этанол, бутанол-1) і цыклічныя (цыклагексанол). Спірты адносяцца да палярных растваральнікаў і прымяняюцца ў розных галінах прамысловасці[128]. Сусветны аб’ём спажывання спіртоў як растваральнік (па даных на 2013 год) склаў каля 6,5 млн тон[129].
Найбольш распаўсюджаным спіртам сярод растваральнікаў з’яўляецца этанол — ягоны сусветны аб’ём спажывання для гэтых мэт (па даных на 2009 год) перавышае 3,5 млн тон у год[130]. Іншымі папулярнымі растваральнікамі з’яўляюцца метанол і ізапрапанол[76] з аб’ёмамі спажывання больш за 1 млн тон у год.
Выкарыстанне спіртоў як растваральнік уключае ў сябе наступныя напрамкі[131]:
- Тэхналагічны растваральнік: экстракцыя і ачыстка натуральных прадуктаў (тлушчы і алеі, смолы, воск, прыродныя фарбавальнікі і араматызатары, альгінаты, вітаміны, алкалоіды, багавінне), носьбіт у харчовай прамысловасці, ачыстка, крышталізацыя і асаджэнне арганічных хімічных рэчываў.
- Растваральнік у вытворчасці фарб і пакрыццяў: растварэнне сінтэтычных палімерных матэрыялаў (лакі, смолы, клеі і г. д.), складальнік цэментаў, фарб і чарніл.
- Ачышчальнік: вытворчасць электронных кампанентаў, металічных паверхняў, фотаплёнак і фотапапер, шклоачышчальнік і іншае, складальнік вадкага мыла і мыйных сродкаў.
- Растваральнік у вытворчасці фармацэўтычнай прадукцыі, парфумерыі і касметыкі.
- Растваральнік у аэразолях (бытавых і медычных).
Павярхоўна-актыўныя і мыйныя рэчывы
[правіць | правіць зыходнік]Найважнейшай сыравінай у вытворчасці сучасных павярхоўна-актыўных рэчываў (ПАР) для сінтэтычных мыйных сродкаў з’яўляюцца вышэйшыя тлустыя спірты, з якіх у залежнасці ад рэагента атрымліваюць неіанагенныя або аніонныя ПАР[132].
Сусветны аб’ём выкарыстання вышэйшых тлустых спіртоў у вытворчасці ПАР у 2000 годзе склаў 1,68 млн тон[132]. У 2003 годзе каля 2,5 млн тон ПАР было выраблена на аснове вышэйшых тлустых спіртоў[133].
Палімерныя матэрыялы і іхнія складовыя
[правіць | правіць зыходнік]Спірты маюць важнае прымяненне як зыходныя манамеры для сінтэзу палімерных матэрыялаў метадам палікандэнсацыі. Галоўным чынам, на аснове спіртоў сінтэзуюць паліэфіры і паліурэтаны. Найважнейшымі прыкладамі такіх сінтэтычных палімераў з’яўляюцца паліэтылентэрэфталат, палібутылентэрэфталат, атрыманыя з тэрэфталевай кіслаты і этыленгліколю або 1,4-бутандыёлу адпаведна. Палікандэнсацыяй гліколяў, гліцэрыны або пентаэрытрыту з фталевым ангідрыдам атрымліваюць алкідныя смолы, якія шырока выкарыстоўваюцца для вырабу лакаў і фарбаў. Паліурэтаны атрымліваюць палікандэнсацыяй ізацыянатаў з гліколямі або шмататамнымі спіртамі[134].
Спірты таксама выкарыстоўваюцца для вытворчасці складанаэфірных і дыэфірных пластыфікатараў для палімераў[135].
Гідраўлічныя вадкасці і змазачныя матэрыялы
[правіць | правіць зыходнік]Для атрымання негаручых гідраўлічных вадкасцей выкарыстоўваюць водныя растворы, якія змяшчаюць гліцэрыну і этанол. У вытворчасці тармазных вадкасцяў шырока выкарыстоўваюць этыленгліколь і эфіры на яго аснове[136].
Многія сучасныя змазачныя матэрыялы маюць у сваім складзе вышэйшыя тлустыя спірты і іхнія эфіры, дзякуючы іхняй нізкай таксічнасці, высокай тэмпературы ўспышкі і бясследнаму выпарэнню пры награванні. Гэтыя ўласцівасці выкарыстоўваюцца для побытавага ўжывання, а таксама для выпадкаў, калі эфект астуджэння паверхні важнейшы за антыфрыкцыйныя ўласцівасці (напрыклад, пры свідраванні, пілаванні або іншай слясарнай апрацоўцы металаў)[137].
Пестыцыды
[правіць | правіць зыходнік]
Не зважаючы на тое, што незамешчаныя гранічныя аліфатычныя спірты маюць фунгіцыдную або гербіцыдную актыўнасці, іхняе прамое выкарыстанне як пестыцыды не знаходзіць шырокага практычнага ўжывання. Адным з нямногіх напрамкаў з’яўляецца іхняе выкарыстанне як рэгулятар росту раслін. Падобныя ўласцівасці маюць этанол, этыленгліколь і іншыя гліколі, некаторыя вышэйшыя тлустыя спірты[138].
Галагензамешчаныя спірты праяўляюць значна большую актыўнасць і маюць ратыцыдную, гербіцыдную і фунгіцыдную актыўнасці. Так, напрыклад, прэпарат гліфтор, які з’яўляецца сумессю 1,3-дыфтарпрапанолу-2 і 1-фтор-3-хларпрапанолу-2, выкарыстоўваецца для барацьбы з мышападобнымі грызунамі і байбакамі[139].
Больш высокая біялагічная актыўнасць назіраецца ў негранічных і водарных спіртоў. Алілавы спірт знаходзіць ужыванне як гербіцыд, шматлікія вышэйшыя негранічныя спірты з’яўляюцца ферамонамі казурак. Актыўнымі акарыцыдамі з’яўляюцца некаторыя водарныя біфенілавыя спірты: дыкафол, хларфенетол, пракланол[139][140].
Многія спірты з’яўляюцца паўпрадуктамі для сінтэзу розных пестыцыдаў[141]. Напрыклад, у вытворчасці гліфасату выкарыстоўваецца метанол[142], кратаксіфосу — α-метылбензілавы спірт[143], пірэтроідаў трэцяга пакалення — 3-фенаксібензілавы спірт[144].
Таксама спірты шырока выкарыстоўваюцца як неводны носьбіт для стварэння таварных кампазіцый пестыцыдаў[145].
Выкарыстанне спіртоў у вытворчасці спажывецкай прадукцыі
[правіць | правіць зыходнік]Харчовая прамысловасць
[правіць | правіць зыходнік]
Асновай усіх алкагольных напояў з’яўляецца этанол, які атрымліваецца пры зброджванні харчовай сыравіны — вінаграду, бульбы, пшаніцы і іншых крухмала- або цукраўтрымліваючых прадуктаў. Акрамя таго, этылавы спірт выкарыстоўваецца як кампанент некаторых харчовых і водарных эсэнцый (араматызатараў), шырока выкарыстоўваных у кулінарыі, пры выпечцы кандытарскіх вырабаў, вытворчасці шакаладу, цукерак, напояў, марожанага, варэнняў, жэле, павідлаў, канфіцюраў і іншага. Аднак этанолам спіс спіртоў, выкарыстоўваных у індустрыі прадуктаў харчавання, не абмяжоўваецца. Спірты можна сустрэць сярод самых розных харчовых дабавак, напрыклад, гліцэрына (E422) выкарыстоўваецца як вільгацеўтрымлівальны агент, растваральнік, загушчальнік, раздзяляльнік[К 9], плеўкаўтваральнік[К 10], сродак для капсуліравання. Шэраг спіртоў знаходзіць ужыванне як цукразаменнікі (ксіліт, маніт, сарбіт, эрытрыт), араматызатары (ментол), фарбавальнікі (лютэін) і г. д.[147]
Парфумерыя, касметыка і бытавая хімія
[правіць | правіць зыходнік]Спірты даволі шырока выкарыстоўваюцца як водарныя рэчывы для складання кампазіцый у парфумерна-касметычнай прамысловасці і вытворчасці араматызатараў для бытавой хіміі і іншай спажывецкай прадукцыі (гераніол, нерол, цытранелол, ментол і іншыя). Апроч надання водару, у парфумерна-касметычнай прадукцыі спірты выкарыстоўваюцца і ў іншых мэтах[148]:
- антыўспеньвальнікі: этанол, прапанол-1, прапанол-2, гексанол;
- антыкаразійныя рэчывы: 2-дыметыламіна-2-метылпрапанол-1;
- антымікробныя прэпараты: 2,4-дыхларбензілавы спірт, (этылендыёксі)дыметанол;
- антыаксіданты: тыадыгліколь;
- антыстатыкі: вышэйшыя тлустыя спірты (С12—С16);
- гідратропныя рэчывы: гексанол;
- маскіровачныя сродкі: бутандыёл-2,3, 2-бензілгептанол-1, барнеол, 3,7-дыметылнанадыен-1,6-ол-3;
- кансерванты: 2-бром-2-нітрапрапандыёл-1,3, бензілавы спірт, 1,1,1-трыхлор-2-метылбутанол-2;
- ахаладжальныя агенты: ментол, 3-метаксіпрапандыёл-1,2;
- пластыфікатары: актандыёл-1,8, 2,2-дыметылпрапандыёл-1,3;
- процісебарэйныя сродкі: ундэканол-1;
- сувязныя: даказанол-1, вышэйшыя тлустыя спірты (С20—С22);
- змякчальнікі: вышэйшыя тлустыя спірты (С9—С16); вышэйшыя гліколі (С15—С30);
- сродкі для завіўкі або выпроствання валасоў: дытыятрэітол, 3-меркаптапрапандыёл-1,2;
- стабілізатары эмульсій: 7-дэгідрахалестэрын, 3-(актадэцылоксі)прапандыёл-1,2, вышэйшыя тлустыя спірты (С9—С50);
- стабілізатары пены: деканол-1, мірыстылавы спірт, цэтылавы спірт, стэарылавы спірт;
- увільгатняльнікі: гексантрыёл-1,2,6, бутандыёл-1,2, бутандыёл-2,3, 2-бутылактанол-1, гліцэрына;
- фіксатары валасоў: 2-(2-амінаэтоксі)этанол;
- эмульгатары: вышэйшыя тлустыя спірты (С40—С60).
Выкарыстанне спіртоў у медыцыне
[правіць | правіць зыходнік]Асноўным спіртам, які ўжываецца ў медыцынскіх мэтах, з’яўляецца этанол. Яго выкарыстоўваюць як вонкавы антысептычны і раздражняльны сродкі для падрыхтоўкі кампрэсаў і абціранняў. Яшчэ больш шырока ўжываецца этылавы спірт для падрыхтоўкі розных настоек, развядзенняў, экстрактаў і іншых лекавых форм[149].
Ужыванне спіртоў як уласна лекавы сродак не гэтак прыкметна, аднак шматлікія прэпараты па фармальнай наяўнасці гідраксільнай групы можна аднесці да разгляданага класа арганічных злучэнняў (кленбутэрол, хларбутанол, маніт, эстрадыёл і іншыя). Напрыклад, у пераліку 10 найважнейшых рэцэптурных прэпаратаў ЗША ў 2000 годзе 6-ы радок займае альбутэрол, утрымліваючы гідраксільную групу[150].
Іншыя напрамкі выкарыстання
[правіць | правіць зыходнік]У наш час цяжка знайсці вобласць практычнай дзейнасці чалавека, дзе б не выкарыстоўваліся спірты ў той ці іншай ролі. Можна вылучыць наступныя малазначныя напрамкі выкарыстання:
- пенаўтваральнікі для флатарэагентаў[151];
- зыходныя прадукты для атрымання выбуховых рэчываў, а таксама іхнія кампаненты (гліцэрына ўжываюцца для сінтэзу нітрагіцэрыны, этыленгліколь — этыленглікальдынітрату, пентаэрытрыт — пентаэрытрыттэтранітрату[152]);
- зыходныя прадукты для атрымання атрутных рэчываў, а таксама кампаненты для іхняй дэгазацыі (ніжэйшыя спірты ўжываюцца для сінтэзу фасфарарганічных баявых атрутных рэчываў: табуна або дыізапрапілфтарфасфату[153]; манаэтаналамін і метылцэлазальв ужываюцца для дэгазацыі[154]).
Заўвагі
[правіць | правіць зыходнік]Каментары
- ↑ Паказчык вымераны пры 22 °C.
- ↑ Паказчык вымераны пры 40 °C.
- ↑ Першыя тры месцы ў спісе займаюць серная кіслата, азот і кісларод адпаведна. У спіс не ўваходзяць злучэнні, якія атрымліваюцца біяхімічнымі метадамі, напрыклад, этанол, які атрымліваецца з расліннай сыравіны.
- ↑ Паводле даных на 2009 год. Разлічана зыходзячы з даных спажывання паліўнага этанолу (біяэтанолу) і прыкладных аб’ёмаў вытворчасці сінтэтычнага этанолу.
- ↑ Значэнне разлічана зыходзячы з даных па аб’ёмах сусветнай прамысловай вытворчасці найбольш распаўсюджаных спіртоў у прамысловасці.
- ↑ Існуюць два асноўныя тэхналагічныя метады атрымання фармальдэгіду з метанолу:
- акісленне з частковым дэгідрыраваннем (каталізатар: серабро; тэмпература: 400—720 °C):
CH3OH → HCHO + H2
2H2+ O2 → 2H2O - прамое акісленне (каталізатар: аксідны жалеза-малібдэнавы; тэмпература: 300—400 °C):
2CH3OH + O2 → 2HCHO + 2H2O
- акісленне з частковым дэгідрыраваннем (каталізатар: серабро; тэмпература: 400—720 °C):
- ↑ Так званы біяметанол, як і звычайны метанол, вырабляецца з сінтэз-газу, які ў сваю чаргу прадукуецца з метану. Пры гэтым, пры атрыманні біяметанолу выкарыстоўваецца так званы біяметан, які ўтвараецца з біялагічных адходаў у працэсе жыццядзейнасці асаблівых бактэрый. Для паліўных патрэб можа быць скарыстаны метанол любой тэхналогіі вытворчасці.
- ↑ Як аксігенавальныя дабаўкі акрамя метанолу, этанолу і бутанолу, могуць выкарыстоўвацца ізапрапанол, прапанол, ізабутанол і іншыя аліфатычныя спірты.
- ↑ Раздзяляльнікі — рэчывы, якія палягчаюць выманне прадуктаў з форм, блях або іншых смажыльных ці фармавалых паверхняў, а таксама, якія перашкаджаюць шчыльнаму кантакту або зліпанню частак прадукта адзін з адным.
- ↑ Плеўкаўтваральнікі — рэчывы, якія наносяцца на паверхню харчовых прадуктаў з ахоўнай мэтай.
Крыніцы
- ↑ alcohols. IUPAC Gold Book. Архівавана з першакрыніцы 22 ліпеня 2011. Праверана 16 снежня 2013.
- ↑ БелЭн 2002.
- ↑ Alcohols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). doi:10.1351/goldbook.A00204. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 2 верасня 2010.
- ↑ Enols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). doi:10.1351/goldbook.E02124. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 2 верасня 2010.
- ↑ Phenols (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). doi:10.1351/goldbook.P04539. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 2 верасня 2010.
- ↑ а б в Senning A. Elsevier's Dictionary of Chemoetymology. The whies and whences of chemical nomenclature and terminology. — Elsevier, 2007. — 434 p. — ISBN 978-0-444-52239-9.
- ↑ Спирт // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : у 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987. (руск.)
- ↑ Спирты / Фросин В. Н. // Большая советская энциклопедия : ([в 30 т.]) / гл. ред. А. М. Прохоров. — 3-е изд.. — М. : Советская энциклопедия, 1969—1978. (руск.)
- ↑ IUPAC Nomenclature of Organic Chemistry (англ.). ACD/Labs. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 24 жніўня 2009.
- ↑ Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова, Р. А. Лидина. — Масква: «Химия», 1983. — С. 129.
- ↑ Леенсон И. А.. Откуда твоё имя?(недаступная спасылка). Журнал «Химия и жизнь - XXI век». Всякая всячина. Архівавана з першакрыніцы 29 чэрвеня 2013. Праверана 24 жніўня 2009.
- ↑ Спермацет // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.) (руск.). — СПб., 1890—1907.
- ↑ John Roach for National Geographic News. 9,000-Year-Old Beer Re-Created From Chinese Recipe. Архівавана з першакрыніцы 10 сакавіка 2013. Праверана 9 сакавіка 2013.
- ↑ Mousdale D. M. Biofuels: Biotechnology, Chemistry, and Sustainable Development. — Boca Raton: CRC Press, Taylor & Francis Group, 2008. — P. 1—2. — ISBN 978-1-4200-5124-7.
- ↑ al-Hassan, Ahmad Y. (2009). "Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century". Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry. Hildesheim: Georg Olms Verlag. pp. 283–298. (той жа кантэнт таксама даступны на сайце аўтара Архіўная копія ад 29 снежня 2015 на Wayback Machine).
- ↑ Григорьева В. З. Водка известная и неизвестная. XIV-XX века (руск.). — Эннеагон Пресс, 2007. — С. 12. — ISBN 9785910510108.
- ↑ а б Этиловый спирт // Химическая энциклопедия (руск.) / Главный редактор H. C. Зефиров. — Масква: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 994—997. — ISBN 5-85270-310-9.
- ↑ Похлёбкин В.В.. Терминология русских спиртных напитков в XIV – XV веках. История водки. vkus.narod.ru. Архівавана з першакрыніцы 24 лютага 2010. Праверана 25 жніўня 2009.
- ↑ Myers R. L. The 100 Most Important Chemical Compounds: A Reference Giude (англ.). — Greenwood Press, 2007. — P. 174. — ISBN 978-0-313-33758-1.
- ↑ Forbes R. J. A Short History of the Art of Distillation: From the Beginnings Up to the Death of Cellier Blumenthal (англ.). — Brill, 1970. — С. 107—108.
- ↑ а б Соловьёв Ю. И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. — 2-е изд., перераб. — Масква: «Просвещение», 1983. — С. 32, 174—175, 240.
- ↑ а б в Фигуровский Н. А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. — Масква: «Просвещение», 1979. — С. 132, 145, 176.
- ↑ Метиловый спирт // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.) (руск.). — СПб., 1890—1907.
- ↑ а б Химическая энциклопедия 1992, с. 118—119, т. 3.
- ↑ Андреас Ф., Грабе К. Химия и технология пропилена = Propylenchemie / Под редакцией Полякова З.Н.. — Ленінград: «Химия», 1973. — С. 53.
- ↑ Рахманкулов Д. Л., Кимсанов Б. X., Чанышев Р. Р. Физические и химические свойства глицерина. — Масква: «Химия», 2003. — С. 8. — ISBN 5-7245-1228-9.
- ↑ Химическая энциклопедия 1992, с. 316—317, т. 1.
- ↑ Гусев М. В., Минеева Л. А. Микробиология (руск.) / Рецензенты: кафедра микробиологии Ленинградского государственного университета. — 2-е изд. — Масква: Издательство Московского университета, 1985. — 376 с. — 10 200 экз.
- ↑ Химическая энциклопедия 1992, с. 337, т. 1.
- ↑ Шлегель Г. Общая микробиология = Allgemeine Mikrobiologie / Перевод с немецкого Л. В. Алексеевой, Г. А. Куреллы, Н. Ю. Несытовой. — Перевод 6-го изд. — Масква: «Мир», 1987. — 567 с. — 22 300 экз.
- ↑ Васильев А. А., Черкаев Г. В., Никитина М. А.. Новый подход к душистым веществам с запахом зелени (pdf)(недаступная спасылка). Англо-русскоязычный общественный химический журнал «Бутлеровские сообщения». Архівавана з першакрыніцы 4 сакавіка 2016. Праверана 11 верасня 2009.
- ↑ Химическая энциклопедия 1992, с. 59, т. 3.
- ↑ Химическая энциклопедия 1992, с. 1024, т. 1.
- ↑ Цитронеллол // Химическая энциклопедия / Главный редактор H.C. Зефиров. — Масква: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 774. — ISBN 5-85270-310-9.
- ↑ Химическая энциклопедия 1992, с. 229, т. 5.
- ↑ Химическая энциклопедия 1992, с. 280, т. 2.
- ↑ Спирты(руск.) // Энцыклапедыя «Кругасвет».
- ↑ Химическая энциклопедия 1992, с. 362, т. 5.
- ↑ а б Лебедева К. В., Миняйло В. А., Пятнова Ю. Б. Феромоны насекомых. — М.: «Наука», 1984. — С. 6—7, 79—82.
- ↑ а б Bullock C. The biochemistry of alcohol metabolism — A brief review(англ.) // Biochemical Education. — 1990. — Т. 18. — № 2. — С. 62—66. — DOI:10.1016/0307-4412 (90)90174-M
- ↑ Химическая энциклопедия / Под ред. И. Л. Кнунянца. — Масква: Большая Российская энциклопедия, 1992. — Т. 1. — С. 382. — ISBN 5-85270-039-8.
- ↑ Химическая энциклопедия 1992, с. 385, т. 1.
- ↑ Химическая энциклопедия 1992, с. 436—437, т. 4.
- ↑ Овчинников Ю. А. Биоорганическая химия. — Масква: Просвещение, 1987. — С. 516.
- ↑ Кольман Я., Рём К.-Г. Наглядная биохимия / Пер. с нем.. — Масква: Бином. Лаборатория знаний, 2011. — С. 156. — ISBN 978-5-9963-0620-6.
- ↑ а б в Ленинджер А. 26.3 Этанол также служит источником энергии // Основы биохимии = Principles of Biochemistry / Перевод с английского канд. биол. наук В. Г. Горбулева, канд. биол. наук М. Д. Гроздовой и канд. мед. наук С. Н. Преображенского, под редакцией акад. В. А. Энгельгардта и проф. Я. М. Варшавского. — Масква: «Мир», 1985. — Т. 3. — С. 821—822. — 1056 с. — 25 000 экз.
- ↑ Sprince H., Parker C. M., Smith G. G., Gonzales L. J. Protection against acetaldehyde toxicity in the rat by L-cysteine, thiamin and L-2-methylthiazolidine-4-carboxylic acid(англ.) // Agents Actions : journal. — 1974. — April — Т. 4. — № 2. — С. 125—130. — DOI:10.1007/BF01966822 — PMID 4842541.(недаступная спасылка)
- ↑ Wiese J. G., Shlipak M. G., Browner W. S. The Alcohol Hangover(англ.) // Annals of Internal Medicine. — 2000. — Т. 132. — № 11. — С. 897—902. — PMID 10836917.
- ↑ Ковтуненко В. А. Лікарські засоби з дією на центральну нервову систему (укр.). — Кіеў, 1997. — С. 46. — 464 с. — ISBN 966-569-170-8.
- ↑ Бухгалтер Э. Б. Метанол и его использование в газовой промышленности. — Масква: Недра, 1986. — С. 180.
- ↑ Метаболизм этанола. Архівавана з першакрыніцы 12 красавіка 2012. Праверана 8 мая 2013.
- ↑ The Clinical Toxicology Laboratory: Contemporary Practice of Poisoning Evaluation / Edired by Shaw L. M.. — Amer. Assoc. for Clinical Chemistry, 2001. — P. 173—174, 186. — ISBN 1-890883-53-0.
- ↑ Daniel C., Nachtman J. P. Toxicology of Alcohols, Ketones and Esters--Inhalation // Review of Inhalants: Euphoria to Dysfunction / Editors: Charles Wm. Sharp, Ph.D., Mary Lee Brehm, Ph.D.. — National Institute of Drug Abuse, 1977. — P. 112—116. — (Research Monograph (15)). Архівавана 15 кастрычніка 2011 года. Архивированная копия(недаступная спасылка). Архівавана з першакрыніцы 15 кастрычніка 2011. Праверана 14 кастрычніка 2010.
- ↑ Химическая энциклопедия 1992, с. 497, т. 5.
- ↑ а б в Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — Масква: «Высшая школа», 1990. — С. 286—287. — ISBN 5-06-001471-1.
- ↑ Термодинамические показатели органических соединений. Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com (1 красавіка 2009). Архівавана з першакрыніцы 8 ліпеня 2011. Праверана 27 жніўня 2009.
- ↑ а б Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленінград: «Химия», 1978.
- ↑ Maréchal Y. The Hydrogen Bond and the Water Molecule: The Physics and Chemistry of Water, Aqueous and Bio-Media (англ.). — Elsevier, 2007. — С. 18. — ISBN 0-444-51957-2.
- ↑ Глава I. Энергии разрыва связей // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону (руск.) / Отв. редактор В. Н. Кондратьев. — Масква: «Наука», 1974. — С. 83.
- ↑ Бушуев Ю. Г., Дубинкина Т. А. Компьютерное моделирование структур метанола и жидкого метана(руск.) // Журнал физической химии. — 1996. — Т. 70. — № 9. — С. 1629.
- ↑ Глава III. Потенциалы ионизации // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону (руск.) / Отв. редактор В. Н. Кондратьев. — Масква: «Наука», 1974. — С. 247—248, 276.
- ↑ Робертс Дж., Касерио М. Основы органической химии = Basic principles of organic chemistry / Под редакцией академика Несмеянова А. Н.. — 2-е, дополненное. — Масква: «Мир», 1978. — Т. 1. — С. 401.
- ↑ Глава XIV. Физико-химические свойства жирных спиртов // Высшие жирные спирты (области применения, методы производства, физико-химические свойства) / Под редакцией С. М. Локтева. — Масква: «Химия», 1970. — С. 283—295.
- ↑ Химическая энциклопедия 1992, с. 800—804, т. 4.
- ↑ Hudlický M. Oxidation in Organic Chemistry (англ.). — ACS monograph 186. — Washington: American Chemical Society, 1990. — P. 57—59. — ISBN 0-8412-1780-7.
- ↑ Хейнс А. Методы окисления органических соединений: Алканы, алкены, алкины и арены = Methods for the oxidation of organic compounds: Alkanes, Alkenes, Alkynes and Arenes / Перевод с англ., под редакцией И.П.Белецкой. — Масква: «Мир», 1988. — С. 82—108. — 400 с. — ISBN 5-03-000149-2.
- ↑ Титце Л., Айхер Т. Препаративная органическая химия: Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории / Пер. с нем.. — Масква: «Мир», 1999. — С. 73—75. — 704 с. — ISBN 5-03-002940-0.
- ↑ Реутов и др. 2010, с. 232—233.
- ↑ Corey E. J., Nicolaou K. C., Shibasaki M., Machida Y., Shiner C. S. Superoxide ion as a synthetically useful oxygen nucleophile(англ.) // Tetrahedron Letters. — 1975. — Т. 16. — № 37. — С. 3183—3186.
- ↑ The changing face of the global methanol industry. CHEMWEEK'S LAB. IHS Chemical Week. Архівавана з першакрыніцы 18 студзеня 2017. Праверана 18 студзеня 2017.
- ↑ Chauvel A., Lefebvre G. Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd ed. — Paris: Editions Technip, 1989. — Т. 2. — P. 69—74. — ISBN 2-7108-0563-4.
- ↑ Berg Ch.. World Fuel Ethanol - Analysis and Outlook (англ.). The Online Distillery Network for Distillers & Fuel Ethanol Plants Worldwide (1 красавіка 2004). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 7 снежня 2020.
- ↑ World Fuel Ethanol Production (англ.). Renewable Fuel Association. Архівавана з першакрыніцы 18 студзеня 2017. Праверана 18 студзеня 2017.
- ↑ а б Papa A. J. Propanols // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a22_173.pub2.
- ↑ Isopropanol (IPA) CAS No: 67-63-0 (англ.). Chemical intelligence. ICIS.com. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 25 мая 2010.
- ↑ а б Isopropyl Alcohol (IPA) (англ.). WP Report. SRI Consulting (1 студзеня 2010). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 25 мая 2010.
- ↑ Chauvel, Lefebre 1989, с. 76—79.
- ↑ Ethylene Glycol (англ.). WP Report. SRI Consulting (1 студзеня 2010). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 25 мая 2010.
- ↑ Rebsdat S., Mayer D. Ethylene Glycol // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a10_101.
- ↑ Product Safety Assessment DOW n-Propanol (англ.) (pdf)(недаступная спасылка). The Dow Chemical Company. Архівавана з першакрыніцы 16 ліпеня 2017. Праверана 25 мая 2010.
- ↑ Christoph R., Schmidt B., Steinberner U., Dilla W., Karinen R. Glycerol // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a12_477.pub2.
- ↑ Speight J. G. Chemical Process and Design Handbook. — McGraw-Hill, 2002. — P. 2.251. — ISBN 0-07-137433-7.
- ↑ Chenier Ph. J. Survey of Industrial Chemistry. — Third Edition. — New York: Kluwer Academic / Plenum Publishers, 2002. — P. 242. — ISBN 0-306-47246-5.
- ↑ Ланге К. Р. Поверхностно-активные вещества: синтез, свойства, анализ, применение = Surfactants. A Practical Handbook / Пер. с англ. — Санкт-Пецярбург: «Профессия», 2004. — С. 18—20. — ISBN 5-93913-068-2.
- ↑ Brackmann B., Hager C.-D.. The Statistical World of Raw Materials, Fatty Alcohols and Surfactants (англ.). CESIO 6th World Surfactants Congress, Berlin, June 20–23, 2004. Laboratory of Formulation, Interfaces, Rheology and Processes FIRP (Venezuela). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 20 верасня 2010.
- ↑ Kosaric N., Duvnjak Z., Farkas A., Sahm H., Bringer-Meyer S., Goebel O., Mayer D. Ethanol // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a09_587.pub2.
- ↑ Hahn H.-D., Dämbkes G., Rupprich N., Bahl H., Frey G. D. Butanols // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a04_463.pub3.
- ↑ Курц А. Л., Брусова Г. П., Демьянович В. М.. Раздел III. Свойства одноатомных спиртов. Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги. ChemNet. Химический факультет МГУ (4 снежня 1999). Архівавана з першакрыніцы 17 лістапада 2009. Праверана 28 жніўня 2009.
- ↑ McMurry J. Organic chemistry. — Seven edition. — Thomson, 2008. — P. 604, 658. — ISBN 0-495-11258-5.
- ↑ Evans D. A.. Evans pKa Table(недаступная спасылка). Архівавана з першакрыніцы 2 кастрычніка 2013. Праверана 14 сакавіка 2013.
- ↑ Реутов и др. 2010, с. 243.
- ↑ Общая органическая химия. Кислородсодержащие соединения = Comprehensive Organic Chemistry / Под ред. Д. Бартона и В. Д. Оллиса. — Масква: «Химия», 1982. — Т. 2. — С. 20.
- ↑ Реутов и др. 2010, с. 244—248.
- ↑ Реутов и др. 2010, с. 248—252.
- ↑ Реутов и др. 2010, с. 258—260.
- ↑ Реутов и др. 2010, с. 260—261.
- ↑ Реутов и др. 2010, с. 265—269.
- ↑ Терней А. Л. Современная органическая химия / Под ред. Н. Н. Суворова. — 2-е, переработанное. — Масква: «Мир», 1981. — Т. 1. — С. 418—421.
- ↑ Химическая энциклопедия 1992, с. 497—498, т. 1.
- ↑ Williams D. L. H. Nitrosation Reactions and The Chemistry of Nitric Oxide (англ.). — First edition. — Elsevier, 2004. — С. 86. — ISBN 0-444-51721-9.
- ↑ а б Шрайнер Р., Фьюзон E., Кёртин Д., Моррилл Т. Идентификация органических соединений (руск.) / Пер. с англ.. — Масква: «Мир», 1983. — С. 167—185.
- ↑ а б Сиггиа С., Ханна Дж. Г. Количественный органический анализ по функциональным группам (руск.) / Пер. с англ.. — Масква: «Химия», 1983. — С. 16—19.
- ↑ Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных / Пер. с англ. — Масква: «Мир», 2006. — С. 336. — (Методы в химии). — ISBN 5-03-003586-9.
- ↑ а б Браун Д., Флойд А., Сейнзбери М. Спектроскопия органических веществ / Пер. с англ.. — М.: «Мир», 1992. — С. 59—60. — ISBN 5-03-002111-6.
- ↑ Преч и др. 2006, с. 208.
- ↑ Ионин Б. И., Ершов Б. А., Кольцов А. И. ЯМР-спектроскопия в органической химии / Под ред. Б. А. Ершова. — 2-е изд., переработанное. — Л.: «Химия», 1983. — С. 177.
- ↑ Chenier 2002, с. 17—18.
- ↑ Chenier 2002, с. 217—219.
- ↑ Chauvel A., Lefebvre G. Petrochemical processes 1. Synthesis-gas Derivatives and Major Hydrocarbons. — 2nd ed. — Paris: Editions Technip, 1989. — Т. 1. — P. 95—97. — ISBN 2-7108-0562-5.
- ↑ Chauvel, Lefebre 1989, с. 53.
- ↑ Speight 2002, с. 1.3.
- ↑ Химическая энциклопедия 1992, с. 106—107, т. 3.
- ↑ Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. и доп. — Масква: «Химия», 1988. — С. 132. — ISBN 5-7245-0008-6.
- ↑ Лебедев 1988, с. 188.
- ↑ Лебедев 1988, с. 133.
- ↑ Chauvel, Lefebre 1989, с. 31—33.
- ↑ Speight 2002, с. 2.212.
- ↑ Chauvel, Lefebre 1989, с. 127—133.
- ↑ Chenier 2002, с. 234.
- ↑ Использование этилового спирта в качестве компонента автомобильного бензина. Анализ нормативной документации (руск.). Законы и практика. Аналитический портал химической промышленности Newchemistry.ru. Архівавана з першакрыніцы 21 снежня 2010. Праверана 12 верасня 2010.
- ↑ Карпов С. А., Кунашев Л. Х., Царев А. В., Капустин В. М. Применение алифатических спиртов в качестве экологически чистых добавок в автомобильные бензины(руск.) // «Нефтегазовое дело». — 2006. — № 2. Архівавана з першакрыніцы 23 верасня 2010.
- ↑ Использование спиртов как добавок к нефтяным топливам (руск.). Альтернативные топлива, энергетика. Аналитический портал химической промышленности Newchemistry.ru. Архівавана з першакрыніцы 4 лістапада 2011. Праверана 12 верасня 2010.
- ↑ Биодизель (руск.)(недаступная спасылка). Российская Национальная Биотопливная Ассоциация. Архівавана з першакрыніцы 21 жніўня 2010. Праверана 12 верасня 2010.
- ↑ Linak E., Inoguchi Y., Janshekar H.. Ethanol (англ.). CEH Report. SRI Consulting (1 красавіка 2009). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 18 жніўня 2010.
- ↑ Global ethanol production to reach 85.9 billion litres in 2010: Global Renewable Fuels Alliance releases 2010 biofuels production forecast (англ.)(недаступная спасылка). Press Release. Global Renewable Fuels Alliance (21 сакавіка 2010). Архівавана з першакрыніцы 2 лютага 2012. Праверана 25 мая 2010.
- ↑ Карпов С. А. Актуальные аспекты применения топливного этанола в России и США // Нефтегазовое дело. — 2006. — № 2. Архівавана з першакрыніцы 15 ліпеня 2007.
- ↑ Smith J. L., Workman J. P.. Alcohol for Motor Fuels (англ.). Colorado State University Extension (1 снежня 2004). Архівавана з першакрыніцы 21 жніўня 2011. Праверана 12 верасня 2010.
- ↑ Дринберг С. А., Ицко Э. Ф. Растворителя для лакокрасочных материалов: Справочное пособие. — 2-е изд., перераб. и доп. — Ленінград: «Химия», 1986. — С. 51.
- ↑ Market Study: Solvents (3rd edition) (англ.). Chemicals. Ceresana. Архівавана з першакрыніцы 7 лістапада 2017. Праверана 7 лістапада 2017.
- ↑ Ethanol Uses and Market Data (англ.). Chemical Intelligence. ICIS.com. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 14 верасня 2010.
- ↑ 2-Propanol (англ.). Environmental Health Criteria (EHC) Monographs. International Programme on Chemical Safety (IPCS) INCHEM. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 18 жніўня 2010.
- ↑ а б Chemistry and Technology of Surfactants / Edited by Richard J. Farn. — Blackwell Publishing Ltd, 2006. — 5—6 p. — ISBN 978-14051-2696-0.
- ↑ Dierker M., Schäfer H. J. Surfactants from oleic, erucic and petroselinic acid: Synthesis and properties(англ.) // European Journal of Lipid Science and Technology. — 2010. — Т. 112. — № 1. — С. 122. Архівавана з першакрыніцы 6 сакавіка 2014.
- ↑ Chanda M., Roy S. K. Industrial Polymers, Specialty Polymers, and Their Applications. — Boca Raton: CRC Press, Taylor & Francis Group, 2009. — P. 1—55—1-58, 1-97—1-98. — ISBN 978-1-4200-8058-2.
- ↑ Барштейн Р. С., Кирилович В. И., Носовский Ю. Е. Пластификаторы для полимеров. — Масква: «Химия», 1982. — С. 19—20.
- ↑ Химическая энциклопедия 1992, с. 546, т. 1.
- ↑ Lubricants and Lubrication / Edited by Theo Mang and Wilfried Dresel. — 2nd edition. — Weinheim: Wiley-VCH GmbH, 2007. — P. 516—517. — ISBN 978-3-527-31497-3.
- ↑ Мельников 1987, с. 106—110.
- ↑ а б Мельников Н. Н. Пестициды. Химия, технология и применение. — Масква: «Химия», 1987. — 710 с.
- ↑ Proclonol (англ.). Compendium of Pesticide Common Names. Alan Wood’s Web site. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 26 верасня 2010.
- ↑ Unger T. A. Pesticide Synthesis Handbook. — New Jersey: Noyes Publications, 1996. — 1080 p. — ISBN 0-8155-1401-8.
- ↑ Unger 1996, с. 277.
- ↑ Unger 1996, с. 294.
- ↑ Мельников 1987, с. 181—182.
- ↑ Guidance Manual for Selecting Protective Clothing for Agricultural Pesticide Operations / Contract No. 68-C9-0037. — Work Assignment 0-20. — Cincinatti: U.S. EPA, 1994. — P. 45. Архівавана 31 ліпеня 2013 года.
- ↑ Сусветная арганізацыя аховы здароўя. Global Status Report on Alcohol 2004. Архівавана з першакрыніцы 27 сакавіка 2013. Праверана 22 сакавіка 2013.
- ↑ Сарафанова Л. А. Пищевые добавки: Энциклопедия. — 2-е изд., испр. и доп. — СПб.: ГИОРД, 2004. — 808 с. — ISBN 5-901065-79-4.
- ↑ List of Functions (англ.). Cosmetics CosIng. European Commission. Health and Consumers. Архівавана з першакрыніцы 21 жніўня 2011. Праверана 8 верасня 2010.
- ↑ Машковский М. Д. Лекарственные средства: В 2 томах. — 14-е изд., перераб., исправ. и доп. — Масква: ООО «Издательство Новая Волна»: Издатель С. Б. Дивов, 2002. — Т. 2. — С. 382. — ISBN 5-7864-0129-4.
- ↑ Chenier 2002, с. 421.
- ↑ Флотация // Химическая энциклопедия / Главный редактор H. C. Зефиров. — Масква: Научное Издательство «Большая Российская Энциклопедия», 1999. — Т. 5. — С. 207—208. — ISBN 5-85270-310-9.
- ↑ Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ: Учебник для вузов. — 3-е изд., перераб. — Ленінград: «Химия», 1981. — С. 263, 278, 281.
- ↑ Франке З. Химия отравляющих веществ / Пер. с нем.. — Масква: «Химия», 1973. — Т. 1. — С. 271, 288.
- ↑ Франке З., Франц П., Варнке В. Химия отравляющих веществ / Пер. с нем., под редакцией акад. И. Л. Кнунянца и д-ра хим. наук Р. Н. Стерлина. — Масква: «Химия», 1973. — Т. 2. — С. 317.
Літаратура
[правіць | правіць зыходнік]Беларускамоўная
- Міляшкевіч Я. Г. Спірты // Беларуская энцыклапедыя: У 18 т. Т. 15: Следавікі — Трыо / Рэдкал.: Г. П. Пашкоў і інш. — Мн. : БелЭн, 2002. — Т. 15. — С. 115. — 10 000 экз. — ISBN 985-11-0035-8. — ISBN 985-11-0251-2 (т. 15).
Англамоўная
- Alcoholic Fuels / Edited by Shelley Minteer. — Boca Raton: CRC Press / Taylor & Francis, 2006. — 273 p. — ISBN 978-0-8493-3944-8.
- Alcohols / Volume Editor: Prof. Jonathan Clayden. — Science of Synthesis: Houben-Weyl Methods of Molecular Transformations. — Georg Thieme Verlag, 2008. — Т. 36. — 1294 p. — (Category 5: Compounds with One Carbon-Heteroatom Bonds). — ISBN 978-1-588-90527-7.
- Catalytic Conversions of Synthesis Gas and Alcohols to Chemicals / Editor: Richard G. Herman. — Plenum Press, 1984. — 475 p. — (American Chemical Society, Middle Atlantic Regional Meeting). — ISBN 0-30-641614-X.
- Mellan I. Polyhydric Alcohols. — Spartan Books. — 1962. — 208 p.
- Monick J. A. Alcohols: Their Chemistry, Properties, and Manufacture. — Reinhold, 1968. — 594 p. — ISBN 0-442-15601-4.
- Monohydric Alcohols: Manufacture, Applications, and Chemistry: based on a symposium / Editor: Edward J. Wickson. — American Chemical Society, 1981. — 222 p. — (ACS symposium series (volume 159)). — ISBN 0-841-20637-6.
- Otera J., Nishikido J. Esterification: Methods, Reactions, and Applications. — Second edition. — Weinheim: Wiley-VCH, 2010. — 374 p. — ISBN 978-3-527-32289-3.
- Tojo G., Fernández M. Oxidation of Alcohols to Aldehydes and Ketones. — First Edition. — New York: Springer, 2006. — 375 p. — ISBN 0-387-23607-4.
- Weissermel K., Arpe H-J. Alcohols // Industrial organic chemistry. — 4th ed. — Weinheim: Wiley-VCH, 2003. — P. 193—266. — ISBN 978-3-527-30578-0.
Рускамоўная
- Спирты // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.) (руск.). — СПб., 1890—1907.
- Высшие жирные спирты (области применения, методы производства, физико-химические свойства) / Под редакцией С. М. Локтева. — Масква: «Химия», 1970. — 329 с.
- Курц А. Л., Брусова Г. П., Демьянович В. М.. Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги(недаступная спасылка). Учебные материалы. Органическая химия. ChemNet. Химический факультет МГУ (4 снежня 1999). Архівавана з першакрыніцы 4 сакавіка 2016. Праверана 10 ліпеня 2010.
- Маркизова Н. Ф., Гребенюк А. Н., Башарин В. А., Бонитенко Е. Ю. Спирты. — СПб.: «Фолиант», 2004. — 112 с. — (Токсикология для врачей). — ISBN 5-93929-089-2.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд.. — Масква: Бином. Лаборатория знаний, 2010. — Т. 2. — ISBN 978-5-94774-614-9.
- Спирты(недаступная спасылка). Энциклопедия по охране и безопасности труда. Том IV. Раздел XVIII. Справочники. Обзор химических соединений. Институт промышленной безопасности, охраны труда и социального партнёрства. Архівавана з першакрыніцы 4 сакавіка 2016. Праверана 27 снежня 2010.






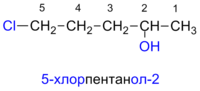
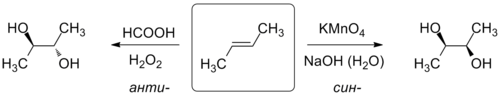
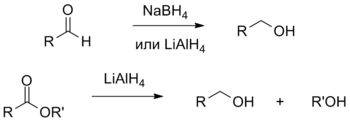
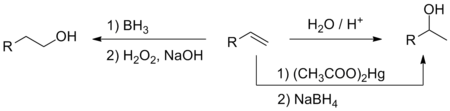
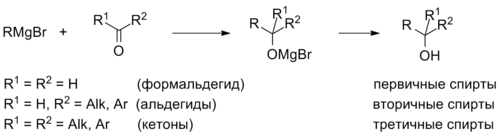
![{\displaystyle {\ce {CO{}+2H2->[{\text{250 °C, 10 МПа}}][{\text{кат.}}]CH3OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecfde5cecf66910d49f80549005be858413514ed)
![{\displaystyle {\ce {C2H4{}+H2SO4->[][{\text{80 °C, 1,3—1,5 МПа}}]C2H5OSO3H{},(C2H5O)2SO2->[{\ce {H2O}}]C2H5OH{}+H2SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15d5d101b5131f1ae1c1924f298f926b1e8e6f93)
![{\displaystyle {\ce {C2H4{}+H2O->[{\ce {H2SO4/SiO2}}][{\text{300 °C, 6—8 МПа}}]C2H5OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4b0cbcd380e857d957c5a680a0cfc67bdc2ed30)
![{\displaystyle {\ce {C2H4{}+CO{}+H2->[{\ce {Rh}}~{\text{кат.}}][{\text{90—130°C, 2,8 МПа}}]CH3CH2CHO->[{\ce {H2}},~{\text{кат.}}][{\text{110—150°C, 0,14—1,0 МПа}}]CH2CH2CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f690fc97f3e4df1bf90a486db34999cd0d0387a6)


![{\displaystyle K_{\text{a}}={\frac {[{\ce {RO-}}]\cdot [{\ce {H3O+}}]}{[{\ce {ROH}}]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac70f186da28a50ea783a0cfb2a61e3a39a0d43)


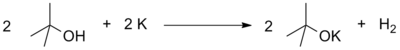



![{\displaystyle K_{{\text{a}}{\ce {H+}}}={\frac {[{\ce {ROH}}]\cdot [{\ce {H+}}]}{[{\ce {ROH2+}}]}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cc6d8f9e60cbd9aec63306c1862e112bbb27dc3)

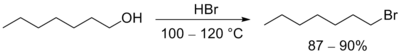
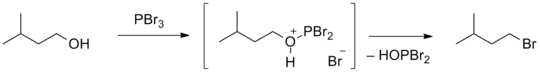
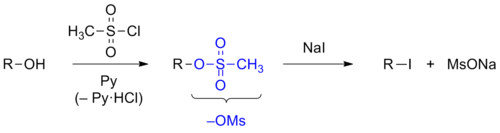

![{\displaystyle {\ce {R-OH ->[{\ce {HCl}}][{\ce {ZnCl2}}] R-Cl{}+ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6802902c2d30c80b3542df1497df4aacb17baa3f)


![{\displaystyle {\ce {[Ce(NO3)6]^{2-}{}+ ROH -> [Ce(OR)(NO3)5]^{2-}{}+ HNO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5fdd8c9ab10027985f8173ed8fd95179ff2cf8d0)
![{\displaystyle {\ce {R-OH->[{\ce {(CH3CO)2O}}][{\text{пиридин}}]R-OCOCH3{}+CH3COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c91ea16f7f3ecb10b63d37e17bd3adac4c76319)
![{\displaystyle {\ce {R-OH ->[{\ce {CH3MgI}}] R-OMgI{}+ CH4 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7e91d21ff92a2f3e50cc4006f5d7cbcbda9dd33)




